Bạn đang xem bài viết Tính chất hóa học của oxit? Khái quát về 4 loại oxit đặc trưng tại thcshuynhphuoc-np.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Tính chất hóa học của oxit là một chủ đề quan trọng trong lĩnh vực hóa học. Oxit là các hợp chất hóa học chứa nguyên tố oxi và có thể được chia thành nhiều loại khác nhau dựa trên tính chất hóa học của chúng. Trong bài viết này, chúng ta sẽ khái quát về 4 loại oxit đặc trưng.
Loại oxit trong hóa học được phân thành 4 loại chính là oxit axit, oxit bazơ, oxit amphoteric và oxit không axit hay oxit quy tắc. Mỗi loại oxit có tính chất hóa học và ứng dụng riêng biệt.
Oxit axit là những hợp chất hóa học chứa nguyên tố oxi và có khả năng tạo ra axit khi tác dụng với nước. Chúng thường có tính chất ăn mòn và có khả năng hòa tan trong nước, tạo ra dung dịch có tính axit mạnh. Một số ví dụ điển hình của oxit axit là SO2, SO3, CO2 và NO2.
Ngược lại, oxit bazơ là những hợp chất chứa nguyên tố oxi và có khả năng tạo ra bazơ khi tác dụng với nước. Chúng thường có tính chất bazơ mạnh và hòa tan trong nước, tạo ra dung dịch có tính bazơ. Ví dụ điển hình của oxit bazơ là CaO, MgO, Na2O và Al2O3.
Oxit amphoteric là loại oxit có khả năng tác dụng như một axit hoặc một bazơ, tùy thuộc vào điều kiện phản ứng. Chúng có tính chất cân bằng và có thể tương tác với cả dung dịch axit và dung dịch bazơ. Ví dụ điển hình của oxit amphoteric là Al2O3 và ZnO.
Cuối cùng, oxit không axit hay oxit quy tắc là những oxit không có khả năng tạo ra axit hoặc bazơ khi tác dụng với nước. Chúng thường có tính chất không ăn mòn và không hòa tan trong nước. Ví dụ điển hình của oxit không axit là CaO và MgO.
Tóm lại, oxit là một loại hợp chất quan trọng trong hóa học với nhiều tính chất và ứng dụng khác nhau. Hiểu rõ về tính chất hóa học của oxit cũng như 4 loại oxit đặc trưng sẽ giúp chúng ta thấy được sự đa dạng và quan trọng của các hợp chất này trong cuộc sống hàng ngày và trong công nghiệp.
Nhắc tới oxi, chắc hẳn ai trong chúng ta cũng đều biết về nó và đã nghe qua. Công dụng của chúng trong đời sống hàng ngày ra sao? Và tính chất hóa học của oxit là gì? Cùng Chúng Tôi tìm hiểu ngay nhé!
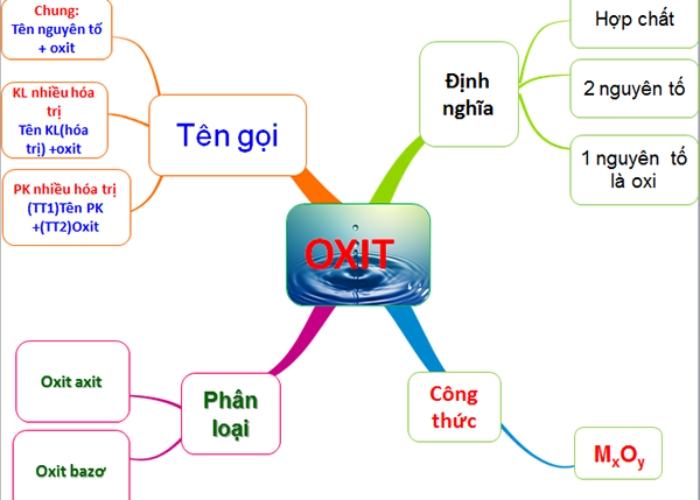
Oxit là gì?
Oxit là gì?
Oxit là hợp chất tạo bởi hai nguyên tố, trong đó có một nguyên tố là oxi.
Công thức tổng quát: MxOy
Trong đó:
- Kí hiệu O kèm theo chỉ số y.
- Kí hiệu nguyên tố M (có hóa trị n) chỉ số x.
- Theo quy tắc hóa trị ta có: 2. y = n . x.
Oxit lưỡng tính là gì?
Oxit lưỡng tính là những oxit vừa tác dụng với dung dịch axit, vừa tác dụng với dung dịch bazơ.
Ví dụ như: Al2O3, ZnO, Cr2O3,…
Lưu ý: Cr2O3 chỉ tan trong NaOH đặc, nóng.
Phương trình hóa học minh họa:
- Al2O3 + 6HCl → 2AlCl3 + 3H2O.
- Al2O3 + 2NaOH → H2O + 2NaAlO2 (natri aluminat).
- ZnO + 2HCl → ZnCl2 + H2O.
- ZnO + 2NaOH → Na2ZnO2 + H2O.
Oxit trung tính là gì?
Oxit trung tính (Oxit không tạo muối) là oxit không phản ứng với nước để tạo bazo hay axit, không phản ứng với bazo hay axit để tạo muối.
Ví dụ: Cacbon monoxit – CO, Nitơ monoxit – NO,…
Cùng Chúng Tôi tiếp tục khám phá tên oxit và tính chất hóa học của oxit ngay nhé!
Cách gọi tên oxit
Đối với kim loại và phi kim chỉ có một hoá trị duy nhất
Cách gọi tên oxit như sau: Tên oxit = Tên nguyên tố + oxit
Ví dụ:
- K2O: Kali oxit.
- NO: Nito oxit.
- CaO: Canxi oxit.
- Al2O3: Nhôm oxit.
- Na2O: Natri oxit.

Đối với kim loại có nhiều hoá trị
Cách gọi tên như sau: Tên oxit = Tên kim loại ( hoá trị ) + oxit
Ví dụ:
- FeO : sắt (II) oxit.
- Fe2O3: sắt (III) oxit.
- CuO: đồng (II) oxit.
Đối với phi kim loại có nhiều hoá trị
Cách gọi tên như sau: Tên oxit = (tiền tố chỉ số nguyên tử phi kim) Tên phi kim + (tiền tố chỉ số nguyên tử oxit) oxit
Tiền tố:
- Mono: nghĩa là 1.
- Đi : nghĩa là 2.
- Tri : nghĩa là 3.
- Tetra : nghĩa là 4.
- Penta : nghĩa là 5.
Vi dụ:
- SO2: Lưu huỳnh đioxit.
- CO2: Cacbon đioxit.
- N2O3: Đinitơ trioxit.
- N2O5: Đinitơ pentaoxit.
Bài viết liên quan:
- 3 tính chất hóa học của oxi quan trọng mà bạn cần nắm vững
- Tính chất là gì? 5 tính chất cần biết trong hóa học
- Tính chất hóa học của nước? Vai trò của nước trong đời sống
Tính chất hóa học của oxit
Tính chất hoá học của oxit bazơ
Tính chất hóa học của oxit đầu tiên là tính chất hoá học của oxit bazơ.
Oxit bazơ tác dụng với nước H2O
Một số oxit bazơ tác dụng với nước tạo thành dung dịch bazơ (kiềm).
PTPƯ: Oxit bazo + H2O → Bazo
Ví dụ:
- BaO(r) + H2O (dd) → Ba(OH)2,(dd).
- K2O + H2O (dd) → 2KOH.
- BaO + H2O (dd) → Ba(OH)2.
- Một số oxit bazơ khác tác dụng với nước như: K2O, Li2O, Rb2O, Cs2O, SrO,…
Oxit bazơ tác dụng với Axit
Oxit bazơ tác dụng với axit tạo thành muối và nước.
PTPƯ: Oxit bazơ + Axit → Muối + H2O
Ví dụ:
- CuO(r) + HCl (dd) → CuCl2, dd + H2O.
- BaO + 2HCl → BaCl2 + H2O.
- Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
Oxit bazơ tác dụng với Oxit axit
Một số oxit bazơ (là những oxit bazơ tan trong nước) tác dụng với oxit axit tạo thành muối.
PTPƯ: Oxit bazơ + Oxit axit → Muối
Ví dụ:
- CaO + CO2 → CaCO3.
- BaO + CO2 → BaCO3.
Tính chất hóa học của oxit axit
Tính chất hóa học của oxit tiếp theo là tính chất hóa học của oxit axit.
Tính tan
Trừ SiO2 thì hầu hết các oxit axit đều tan trong nước để tạo thành dung dịch axit.
Ví dụ:
- SO3 + H2O → H2SO4.
- P2O5 + 3H2O → 2H3PO4.
- N2O5 + H2O → 2HNO3.
- SO2 + H2O→ H2SO3.
Tác dụng với oxit bazơ tan để tạo ra muối
Thông thường đó là các oxit tác dụng được với nước (Na2O, CaO, K2O, BaO).
Ví dụ:
- SO3 + CaO → CaSO4.
- P2O5 + 3Na2O → 2Na3PO4.
Oxit axit tác dụng với nước H2O
Đa số các loại oxit axit khi tác dụng với nước H2O sẽ tạo ra dung dịch axit trừ SiO2.
Ví dụ:
- SO3 + H2O → H2SO4.
- CO2 + H2O→ H2CO3 (Phản ứng thuận nghịch).
Tác dụng với bazơ tan
Bazơ tan là bazơ của kim loại kiềm và kiềm thổ mới. Cụ thể, có 4 bazơ tan như sau: NaOH, Ca(OH)2, KOH, Ba(OH)2.
- Ví dụ: P2O5 + 6KOH → 2K3PO4 + 3H2O
- Tuỳ vào tỉ lệ mol giữa oxit axit và bazơ tham gia phản ứng mà sản phẩm tạo ra sẽ khác nhau.
- Có thể là nước + muối trung hòa, muối axit hoặc hỗn hợp 2 muối.
Gốc axit tương ứng có hoá trị II
Đối với kim loại trong bazơ có hoá trị I:
- Tỉ lệ mol bazo và oxit axit là 1: Phản ứng tạo muối axit: NaOH + SO2→ NaHSO3.
- Tỉ lệ mol bazo và oxit axit là 2: Phản ứng tạo muối trung hoà: 2KOH + SO3 → K2SO3 +H2O.
Đối với kim loại trong bazơ có hoá trị II:
- Tỉ lệ mol bazo và oxit axit là 1: Phản ứng tạo muối trung hoà: CO2 + Ca(OH)2 → CaCO3.
- Tỉ lệ mol bazo và oxit axit là 2: Phản ứng tạo muối axit: SiO2 + Ba(OH)2 → BaSiO3.
Gốc axit tương ứng có hoá trị III
Đối với kim loại có hoá trị I:
- Tỉ lệ mol bazo và oxit axit là 6: P2O5 + 6NaOH → 2Na2HPO4 +H2O.
- Tỉ lệ mol bazo và oxit axit là 4: P2O5 + 4NaOH → 2NaH2PO4 +H2O.
- Tỉ lệ mol bazo và oxit axit là 2: P2O5 + 2NaOH +H2O → 2NaH2PO4.
Tính chất hóa học của oxit lưỡng tính
Kế tiếp tính chất hóa học của oxit còn thể hiện qua tính chất hóa học của oxit lưỡng tính.
Một số oxit vừa tác dụng dung dịch axit, vừa tác dụng với dung dịch bazơ, gọi là oxit lưỡng tính.
Ví dụ như: Al2O3, ZnO, SnO, Cr2O3,…
Ví dụ:
- Al2O3 + 6HCl → 2AlCl3 + 3H2O.
- Al2O3 + 2NaOH → H2O + 2NaAlO2 (natri aluminat).
Tính chất hóa học của oxit trung tính (oxit không tạo muối)
Cuối cùng tính chất hóa học của oxit là tính chất hóa học của oxit trung tính (oxit không tạo muối). Một số oxit không tác dụng với axit, dung dịch, bazơ, nước, gọi là oxit trung tính như: NO, N2O, CO,…
Phân loại oxit
Từ tính chất hóa học của oxit thì oxit có thể được phân thành hai loại chính:
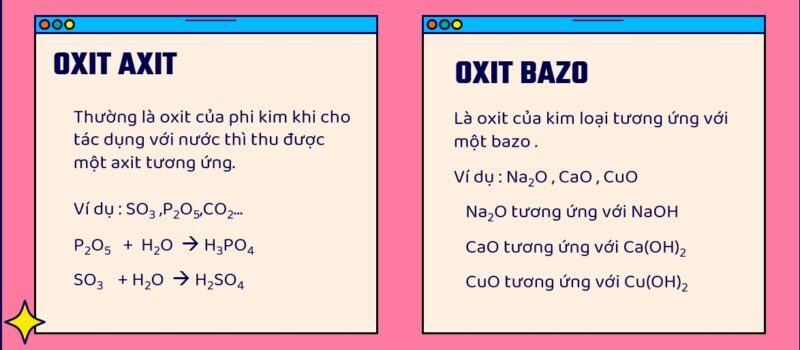
Oxit axit
Oxit axit thường là oxit của phi kim và tương ứng với một axit.
Ví dụ:
- CO2: axit tương ứng là axit cacbonic H2CO3.
- SO2: axit tương ứng là axit sunfuric H2SO4.
- P2O5: axit tương ứng là axit phophoric H3PO4.
Oxit bazơ
Oxit bazơ: là oxi của kim loại và tương ứng với một bazơ.
Ví dụ:
- CaO: bazo tương ứng là canxi hidroxit Ca(OH)2.
- CuO: bazo tương ứng là đồng hidroxit Cu(OH)2.
- Fe2O3: bazo tương ứng là Fe(OH)3.
Ngoài ra, còn có oxit lưỡng tính và oxit trung tính
- Oxit lưỡng tính là oxit có thể tác dụng với axit hoặc bazơ tạo ra muối và nước. Ví dụ: Al2O3,ZnO,…
- Oxit trung tính là oxit không phản ứng với nước để tạo ra bazơ hay axit nhưng oxit này không phản ứng với bazơ hay axit để tạo muối. Ví dụ: Cacbon monoxit, Nitơ monoxit,…

Bài tập về tính chất hóa học của oxit
Bài 1 trang 6 SGK Hóa 9: Có những oxit sau: CaO, Fe2O3, SO3. Dựa vào tính chất hóa học của oxit cho biết. Oxit nào có thể tác dụng được với:
- Nước.
- Axit clohiđric.
- Natri hiđroxit.
Viết các phương trình phản ứng.
Hướng dẫn giải bài 1:
Theo tính chất hóa học của oxit, ta có các PTHH như sau:
Những oxit tác dụng với nước:
- CaO + H2O → Ca(OH)2.
- SO3 + H2O → H2SO4.
Những oxit tác dụng với axit clohiđric:
- CaO + 2HCl → CaCl2 + H2O.
- Fe2O3 + 6HCl → 2FeCl3 + 3H2O.
Những oxit tác dụng với dung dịch natri hiđroxit:
- SO3 + NaOH → NaHSO4.
- SO3 + 2NaOH → Na2SO4 + H2O.
Bài 2 trang 6 SGK Hóa 9: Có những chất sau: H2O, KOH, K2O, CO2. Dựa vào tính chất hóa học của oxit cho biết. Những cặp chất nào có thể tác dụng với nhau.
Hướng dẫn giải bài 2:
Theo tính chất hóa học của oxit, ta có các PTHH như sau:
Những cặp chất tác dụng với nhau từng đôi một:
- H2O + CO2 → H2CO3.
- H2O + K2O → 2KOH.
- 2KOH + CO2 → K2CO3 + H2O.
- KOH + CO2 → KHCO3.
- K2O + CO2 → K2CO3.
Bài 3 trang 6 SGK Hóa 9:
Từ những chất sau: Canxi oxit, lưu huỳnh đioxit, cacbon đioxit, lưu huỳnh trioxit, kẽm oxit. Dựa vào tính chất hóa học của oxit em hãy chọn một chất thích hợp điền vào các phản ứng:
- Axit sunfuric + … → kẽm sunfat + nước.
- Natri hiđroxit + … → natri sunfat + nước.
- Nước + … → axit sunfurơ.
- Nước + … → canxi hiđroxit.
- Canxi oxit + … → canxi cacbonat.
Dùng các công thức hóa học để viết tất cả những phương trình phản ứng hóa học trên.
Hướng dẫn giải bài 3:
Theo tính chất hóa học của oxit, ta có các PTHH như sau:
- H2SO4 + ZnO → ZnSO4 + H2O.
- 2NaOH + SO3 → Na2SO4 + H2O.
- H2O + SO2 → H2SO3.
- H2O + CaO → Ca(OH)2.
- CaO + CO2 → CaCO3.
Bài 4 trang 6 SGK hóa 9:
Cho những oxit sau: CO2, SO2, Na2O, CaO, CuO. Dựa vào tính chất hóa học của oxit. Hãy chọn những chất đã cho tác dụng được với
- Nước, tạo thành dung dịch axit.
- Nước, tạo thành dung dịch bazơ.
- Dung dịch axit, tạo thành muối và nước.
- Dung dịch bazơ, tạo thành muối và nước.
Viết các phương trình hóa học.
Hướng dẫn giải bài 4:
Theo tính chất hóa học của oxit, ta có các PTHH như sau:
Chất tác dụng với nước, tạo thành dung dịch axit: CO2, SO2.
- CO2 + H2O → H2CO4.
- SO2 + H2O → H2SO3.
Chất tác dụng với nước, tạo thành dung dịch bazơ: Na2O, CaO.
- N2O + H2O → NaOH.
- CaO + H2O → Ca(OH)2.
Chất tác dụng với dd axit, tạo thành muối và nước: Na2O, CaO, CuO.
- Na2O + 2HCl → 2NaCl + H2O.
- CaO + 2HCl → CaCl2 + H2O.
- CuO + 2HCl → CuCl2 + H2O.
Chất tác dụng với dung dịch bazơ, tạo thành muối và nước: CO2, SO2.
- CO2 + 2NaOH → Na2CO3 + H2O.
- SO2 + 2NaOH → Na2SO3 + H2O.
Bài 5 trang 6 SGK hóa 9: Có hỗn hợp khí CO2 và O2 làm thế nào có thể thu được khí O2 từ hỗn hợp trên? Trình bày cách làm và viết phương trình hóa học.
Hướng dẫn giải bài 5:
Dẫn hỗn hợp khí CO2 và O2 đi qua bình đựng dung dịch kiềm dư (NaOH, Ca(OH)2,…). Khí CO2 bị giữ lại trong bình vì có phản ứng với kiềm.
Theo tính chất hóa học của oxit, ta có các PTHH như sau:
- CO2+ 2NaOH → Na2CO3 + H2O.
- Hoặc CO2+ Ca(OH)2 → CaCO3 + H2O.
- Chất khí đi ra khỏi lọ là oxi tinh khiết.
Bài 6 trang 6 SGK hóa 9: Cho 1,6 gam đồng (II) oxit tác dụng với 100 gam dung dịch axit sunfuric có nồng độ 20%.
- Viết phương trình hóa học.
- Tính nồng độ phần trăm của các chất có dung dịch sau khi phản ứng kết thúc.
Hướng dẫn giải bài 6:
Theo tính chất hóa học của oxit, ta có các PTHH như sau:
- PTHH: CuO + H2S04 → CuSO4 + H2O
Nồng độ phần trăm các chất:
Số mol các chất đã dùng:
- nCuO = 1,6/80 = 0,02 (mol).
- nH2SO4= 20/98 ≈ 0,2 (mol).
Theo phương trình hóa học thì toàn lượng CuO tham gia phản ứng và H2SO4 dư.
Khối lượng CuSO4 sinh ra sau phản ứng:
- nCuSO4= nCuO = 0,02 mol.
- mCuS04= 160 . 0,02 = 3,2 (g).
Khối lượng H2SO4còn dư sau phản ứng:
- Số mol H2SO4 tham gia phản ứng là 0,02 mol, có khối lượng: mH2SO4 = 98 . 0,02 = 1,96 (g).
- Khối lượng H2SO4 dư sau phản ứng: mH2SO4 dư= 20 – 1,96 = 18,04 (g).
Nồng độ phần trăm các chất trong dung dịch sau phản ứng:
- Khối lượng dung dịch sau phản ứng: mdd= 100 +1,6= 101,6 (g).
- Nồng độ CuSO4 trong dung dịch: C% CuSO4 = 3,2*100% / 101,6 ≈ 3,15%.
- Nồng độ H2SO4 dư trong dung dịch: C%H2SO4= 18,04x 100% / 101,6 ≈ 17,76%.
Bài 1 Trang 21 SGK Hóa 9: Có những oxit sau: SO2, CuO, CaO, Na2O, CO2. Hãy cho biết những oxit nào tác dụng được với
- Nước.
- Axit clohiđric.
- Natri hiđroxit.
Viết các phương trình hóa học.
Hướng dẫn giải bài 1:
Theo tính chất hóa học của oxit, ta có các PTHH như sau:
Những oxit tác dụng với nước là: SO2, Na2O, CO2.
- SO2 + H2O → H2SO3.
- Na2O + H2O → 2NaOH.
- CO2 + H2O → H2CO3.
Những oxit tác dụng với HCl là CuO, Na2O, CaO.
- CuO + 2HCl → CuCl2 + H2O.
- Na2O + 2HCl → 2NaCl + H2O.
- CaO + 2HCl → CaCl2+ H2O.
Những oxit tác dụng với natri hiđroxit là SO2 và CO2.
- SO2 + 2NaOH → Na2SO3 + H2O.
- CO2 + 2NaOH → Na2CO3 + H2O.
Bài 2 Trang 21 SGK Hóa 9: Những oxit nào dưới đây (1) H2O; (2) CuO; (3) Na2O; (4) CO2; (5) P2O5 có thể điều chế bằng
- Phản ứng hóa hợp? Dựa vào tính chất hóa học của oxit hãy viết phương trình hóa học
- Phản ứng hóa hợp và phản ứng phân hủy? Dựa vào tính chất hóa học của oxit hãy viết phương trình hóa học
Hướng dẫn giải bài 2:
Theo tính chất hóa học của oxit, ta có các PTHH như sau:
Cả 5 oxit đã cho đều có thể điều chế bằng phản ứng hóa hợp. Vì các nguyên tố H, Cu, Na, P đều tác dụng được với oxi.
- 2H2 + O2 → 2H2O.
- 2Cu + O2 → 2CuO.
- 4Na + O2 → 2Na2O.
- 4P + 5O2 → 2P2O5.
- C + O2 → CO2.
Các oxit CuO, CO2 có thể được điều chế bằng phản ứng phân hủy.
Ví dụ:
- Cu(OH)2 CuO + H2O.
- CaCO3 CaO + CO2.
Bài 3 Trang 21 SGK Hóa 9
Khí CO được dùng làm chất đốt trong công nghiệp, có lẫn tạp chất là các khí SO2 và CO2. Làm thế nào có thể loại bỏ được những tạp chất ra khỏi CO bằng hóa chất rẻ tiền nhất?
Viết các phương trình hóa học
Hướng dẫn giải bài 3
Để loại bỏ SO2 và CO2 ta dùng dung dịch bazơ. Dung dịch bazơ rẻ tiền nhất là dung dịch nước vôi trong Ca(OH)2. Dẫn hỗn hợp khí đi qua dung dịch Ca(OH)2 dư, toàn bộ SO2 và CO2 bị hấp thụ hết xảy ra phản ứng hóa học sau:
- CO2 + Ca(OH)2 → CaCO3 + H2O.
- SO2 + Ca(OH)2 → CaSO3 + H2O.
- Khí CO không phản ứng, thoát ra, ta thu được khí CO.
Bài 4 Trang 21 SGK Hóa 9: Cần phải điều chế một lượng muối đồng (II) sunfat. Phương pháp nào sau đây tiết kiệm được axit sunfuric?
- Axit sunfuric tác dụng với đồng (II) oxit
- Axit sunfuric đặc tác dụng với kim loại đồng.
Hướng dẫn giải bài 4
Gọi số mol của H2SO4 ở cả 2 phản ứng có lượng như nhau là a mol
a) H2SO4 + CuO → CuSO4 + H2O
a → a
b) 2H2SO4 + Cu → CuSO4 + SO2 + 2H2
a → a/2
Nhìn vào tỉ lệ số mol ở 2 phương trình a) và b). Ta nhận thấy khối lượng đồng sunfat sinh ra ở phương trình a) sẽ nhiều hơn. Chính vì vậy sử dụng phương pháp ở ý a sẽ tiết kiệm H2SO4.

Hy vọng các bạn biết được oxit là gì và các bài tập về tính chất hoá học của oxit. Đừng quen share và follow bài viết để Chúng Tôi có thêm động lực chia sẻ kiến thức nữa nhé.
Trong bài viết này, chúng ta đã tìm hiểu về tính chất hóa học của oxit và khái quát về 4 loại oxit đặc trưng.
Oxit là một loại hợp chất hóa học được tạo thành từ nguyên tố oxi kết hợp với các nguyên tố khác thông qua liên kết hóa học. Tính chất hóa học của oxit phụ thuộc vào nguyên tố kết hợp với oxi và cấu trúc của hợp chất.
Tính chất hóa học chính của oxit bao gồm tính chất oxi hóa, tính chất bazơ, tính chất axit và tính chất amphoteric. Tùy thuộc vào nguyên tố kết hợp với oxi, oxit có thể có tính oxi hóa hoặc tính khử. Các oxit của kim loại thường có tính oxi hóa, trong khi các oxit của phi kim có thể có tính oxi hóa hoặc tính khử.
4 loại oxit đặc trưng gồm oxit axit, oxit bazơ, oxit amphoteric và oxit không kim loại. Oxit axit là oxit được tạo thành từ nguyên tố không kim loại kết hợp với oxi, mà khi tác dụng với nước tạo thành axit. Oxit bazơ là oxit được tạo thành từ kim loại kết hợp với oxi, mà khi tác dụng với nước tạo thành bazơ. Oxit amphoteric là oxit có khả năng tác dụng với cả axit và bazơ. Oxit không kim loại là oxit được tạo thành từ phi kim kết hợp với oxi.
Tuy nhiên, không phải tất cả những oxit đều thuộc vào 4 loại trên. Một số oxit có tính chất đặc biệt và không thuộc vào bất kỳ nhóm nào. Ví dụ, oxit peroxit có chứa hai nguyên tử oxi và có tính chất mạnh oxi hóa. Oxit peroxit thường được sử dụng trong quá trình khử trùng vì khả năng tiêu diệt vi khuẩn và vi rút.
Tóm lại, tính chất hóa học của oxit rất đa dạng và phụ thuộc vào nguyên tử kết hợp với oxi. Tuy có nhiều loại oxit đặc trưng như oxit axit, oxit bazơ, oxit amphoteric và oxit không kim loại, cũng cần nhớ rằng có những oxit có tính chất đặc biệt khác nhau. Hiểu rõ về tính chất của oxit giúp chúng ta áp dụng vào nhiều lĩnh vực khác nhau nhưng hợp chất và ứng dụng công nghệ.
Cảm ơn bạn đã xem bài viết Tính chất hóa học của oxit? Khái quát về 4 loại oxit đặc trưng tại thcshuynhphuoc-np.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Tính chất hóa học của oxit
2. Hợp chất oxi và kim loại
3. Ôxi hóa và khử trong phản ứng oxit
4. Liên kết hoá học trong oxit
5. Tính chất màu sắc của oxit
6. Tính chất độc hại của oxit
7. Tính chất phản ứng của oxit với nước
8. Tính chất phản ứng của oxit với axit
9. Tính chất phản ứng của oxit với bazơ
10. Tính chất điện hóa của oxit
11. Tính chất phân cực của oxit
12. Tính chất tạo ion của oxit
13. Tính chất hóa học của oxit không kim loại
14. Tính chất phân hủy của oxit
15. Tính chất sinh học của oxit.
Loại oxit đặc trưng:
1. Oxít không kim loại: ví dụ như oxit cacbon (CO2), oxit nitơ (NO2)
2. Oxít kim loại kiềm: ví dụ như oxit natri (Na2O)
3. Oxít kim loại kiềm thổ: ví dụ như oxit nhôm (Al2O3)
4. Oxít kim loại phi kim: ví dụ như oxit sắt (Fe2O3)
Lưu ý: Việc xếp loại oxit theo đặc trưng có thể thay đổi theo từng nguồn tài liệu, do có nhiều cách phân loại khác nhau tùy thuộc vào tiêu chí đánh giá.


