Bạn đang xem bài viết Tổng hợp công thức hóa học lớp 8 chi tiết nhất tại thcshuynhphuoc-np.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Công thức hóa học là một khái niệm quan trọng trong môn hóa học, giúp chúng ta biểu diễn và miêu tả cách các nguyên tử kết hợp với nhau để tạo thành các phân tử và chất. Từ việc hiểu và áp dụng công thức hóa học, chúng ta có thể giải thích và dự đoán các quá trình hóa học, từ những phản ứng đơn giản đến những quá trình phức tạp.
Trong chương trình hóa học lớp 8, chúng ta tiếp cận với một số khái niệm cơ bản về công thức hóa học. Đầu tiên, chúng ta học về cách viết công thức phân tử của các chất đơn giản như nước (H2O), khí hiđro (H2) hay khí oxy (O2). Tiếp theo, chúng ta tìm hiểu cách viết công thức hợp chất hóa học bằng cách sử dụng biểu tượng nguyên tử và chỉ số như H2SO4 hay NaCl.
Bên cạnh đó, chúng ta cũng học về công thức cấu tạo hạt nhân của các nguyên tử và cách tính số nguyên tử trong một chất. Công thức hóa học cũng giúp chúng ta xác định cấu trúc của một phân tử bằng cách biểu diễn các liên kết hóa học giữa các nguyên tử.
Trong chương trình hóa học lớp 8, chúng ta tìm hiểu và thực hành việc viết, đọc và hiểu công thức hóa học dựa trên kiến thức cơ bản. Bằng việc nắm vững và áp dụng công thức hóa học, chúng ta có thể khám phá và hiểu sâu hơn về thế giới xung quanh chúng ta và ứng dụng kiến thức này vào các lĩnh vực khác nhau trong cuộc sống hàng ngày.
Chương trình hóa học lớp 8 xoay quanh kiến thức về chất, nguyên tử, phương trình hóa học,… Bài viết này của Chúng Tôi sẽ giúp bạn tổng hợp các công thức hóa học lớp 8 đầy đủ nhất!
Công thức Hóa học lớp 8 cần nhớ
Công thức tính số Mol
Ta có các công thức tính số Mol như sau:
![]()
Trong đó:
- m: khối lượng (đơn vị: gam).
- M: khối lượng mol (đơn vị: g/mol).

Công thức này áp dụng cho tính số mol khí ở điều kiện chuẩn.
Trong đó:
- V: thể tích khí ở điều kiện chuẩn (đơn vị: lít).

Công thức này áp dụng cho chất khí.
Trong đó:
- P: áp suất (đơn vị: atm)
- V: thể tích (đơn vị: lít)
- R: hằng số (R = 0,082)
- T: Nhiệt độ kenvin (T = oC + 273)

Trong đó:
- CM: nồng độ dung dịch (đơn vị: mol/ lít).
- Vdd: thể tích dung dịch (đơn vị: lít).

Trong đó:
- N: số nguyên tử hoặc phân tử.
- NA: số avogadro (NA = 6,02.1023).

Công thức tính nồng độ dung dịch
Ta có các công thức tính nồng độ dung dịch/nồng độ mol của dung dịch như sau:
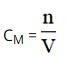
Trong đó:
- n: số mol chất tan (đơn vị: mol).
- V: thể tích dung dịch (đơn vị: lít).
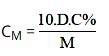
Trong đó:
- D: khối lượng riêng (đơn vị: g/ml)
- C%: nồng độ phần trăm (đơn vị: C%)
- M: khối lượng mol (đơn vị: g/mol)
Công thức tính tỉ khối
- Công thức tính tỉ khối của khí A với khí B:
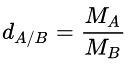
- Công thức tính tỉ khối của khí A với không khí:
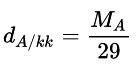
Trong đó:
- D là khối lượng riêng.
- MA; MB lần lượt là khối lượng mol khí A và khí B (đơn vị: g/mol).

Công thức tính thể tích
- Thể tích chất khí ở điều kiện tiêu chuẩn:
V= n x 22,4
- Thể tích của chất rắn và chất lỏng:
![]()
- Thể tích ở điều kiện không tiêu chuẩn:
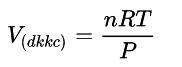
Trong đó:
- P: áp suất (atm)
- R: hằng số (22,4:273)
- T: nhiệt độ: oK (oC+ 273)
Tính thành phần phần trăm về khối lượng của mỗi nguyên tố trong hợp chất
Giả sử hỗn hợp gồm hai chất A và B:

Trong đó:
- mhh; mA; mB lần lượt là khối lượng hỗn hợp, khối lượng chất A, khối lượng chất B (đơn vị: gam).
Tính nồng độ phần trăm
Công thức tính nồng độ phần trăm là một trong những công thức hóa học lớp 8 bạn cần ghi nhớ. Theo đó, ta tính nồng độ phần trăm các chất theo công thức sau:
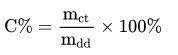
Trong đó:
- mct là khối lượng chất tan.
- mdd là khối lượng dung dịch.
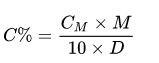
Trong đó:
- CM: nồng độ mol (mol/lít)
- D: khối lượng riêng (g/ml)
- M: khối lượng mol (g/mol)

Độ tan
Công thức tính độ tan như sau:
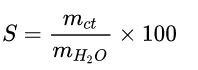
Trong đó:
mct: khối lượng chất tan.
Cách tính nguyên tử khối
Nguyên tử khối của A được tính bằng công thức sau:
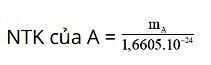
Trong đó:
- mA là khối lượng nguyên tử A (đơn vị gam).
- 1 đvC = 1u = 1,6605.10-27kg = 1,6605.10-24 gam.
Ví dụ:


Định luật bảo toàn khối lượng
Cho phản ứng: A + B → C + D
Áp dụng định luật bảo toàn khối lượng, ta có:
mA + mB = mC + mD
Trong đó:
mA, mB, mC, mD lần lượt là khối lượng của các chất A,B,C,D.
Tính hiệu suất phản ứng
Dựa vào 1 trong các chất tham gia phản ứng:
H%= (Lượng thực tế đã dùng phản ứng : Lượng tổng số đã lấy) x 100%
Dựa vào 1 trong các chất tạo thành
H% = (Lượng thực tế thu được : Lượng thu theo lí thuyết) x 100%
Xem thêm: Tính chất của oxi chương trình lớp 8 – Bài tập minh họa
Các dạng bài tập Hóa học cơ bản lớp 8 – SBT, SGK
Để nắm vững các công thức hóa học lớp 8, mời bạn cùng Chúng Tôi ôn luyện các dạng bài tập cơ bản trong SBT và SGK nhé!
Công thức Hóa học và tính theo công thức Hóa học
1. Lập công thức hóa học của hợp chất khi biết hóa trị
Các bước để xác định hóa trị như sau:
Bước 1: Viết công thức dạng AxBy
Bước 2: Đặt đẳng thức: x hóa trị của A = y × hóa trị của B.
Bước 3: Chuyển đổi thành tỉ lệ: 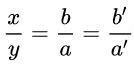
= Hóa trị của B/Hóa trị của A
Chọn a’, b’ là những số nguyên dương và tỉ lệ b’/a’ là tối giản → x = b (hoặc b’); y = a (hoặc a’)
2. Tính thành phần % theo khối lượng của các nguyên tố trong hợp chất AxByCz
Cách 1:
- Tìm khối lượng mol của hợp chất.
- Tìm số mol nguyên tử mỗi nguyên tố trong 1 mol hợp chất rồi quy về khối lượng.
- Tìm thành phần phần trăm các nguyên tố trong hợp chất.
Cách 2: Xét công thức hóa học: AxByCz
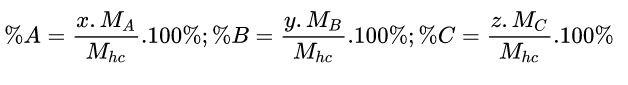 %C có thể được tính theo công thức như sau: %C = 100% – (%A + %B)
%C có thể được tính theo công thức như sau: %C = 100% – (%A + %B)
3. Lập công thức hóa học của hợp chất khi biết thành phần phần trăm (%) về khối lượng
Các bước xác định công thức hóa học của hợp chất:
- Bước 1: Tìm khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
- Bước 2: Tìm số mol nguyên tử của nguyên tố có trong 1 mol hợp chất.
- Bước 3: Lập công thức hóa học của hợp chất.
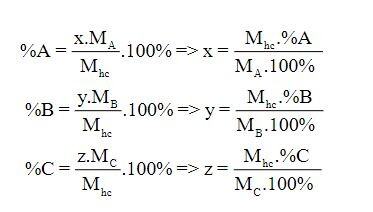
4. Lập công thức hóa học dựa vào tỉ lệ khối lượng của các nguyên tố
a. Bài tập tổng quát:
Cho một hợp chất gồm 2 nguyên tố A và B có tỉ lệ về khối lượng là a:b
Hay
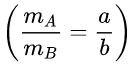
. Tìm công thức của hợp chất.
b. Phương pháp giải
Gọi công thức hóa học tổng quát của 2 nguyên tố có dạng là AxBy. (Ở đây chúng ta phải đi tìm được x, y của A, B. Tìm tỉ lệ: x:y → x, y).
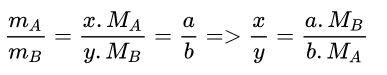
→ Công thức hóa học

Phương trình Hóa học & tính theo phương trình Hóa học
1. Phương trình hóa học
a. Cân bằng phương trình hóa học
a) CuO + H2 → Cu + H2O
b) CO2 + NaOH → Na2CO3 + H2O
c) Zn + HCl → ZnCl2 + H2
d) Al + O2 → Al2O3
e) NaOH + CuSO4 → Cu(OH)2 + Na2SO4
f) Al2O3 + NaOH → NaAlO2 + H2O
g) Fe(OH)3 → Fe2O3 + H2O
h) H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O
i) BaCl2 + AgNO3 → AgCl + Ba(NO3)2
k) FeO + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Lời giải chi tiết:
a) CuO + H2 → Cu + H2O
b) CO2 + 2NaOH → Na2CO3 + H2O
c) Zn + 2HCl → ZnCl2 + H2
d) 4Al + 3O2 → 2Al2O3
e) 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
f) Al2O3 + 2NaOH → 2NaAlO2 + H2O
g) 2Fe(OH)3 → Fe2O3 +3 H2O
h) 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 3H2O
i) BaCl2 + 2AgNO3 → 2AgCl + Ba(NO3)2
k) 2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
b. Hoàn thành các phương trình hóa học sau:
1) Photpho + khí oxi → Photpho(V) oxit (P2O5)
2) Khí hidro + oxit sắt từ (Fe3O4) → Sắt + Nước
3) Kẽm + axit clohiđric → kẽm clorua + hidro
4) Canxi cacbonat + axit clohidric → canxi clorua + nước + khí cacbonic
5) Sắt + đồng (II) sunfat → Sắt (II) sunfat + đồng
Lời giải chi tiết:
1) Photpho + khí oxi → Photpho(V) oxit (P2O5)
2P + 5O2 → P2O5
2) Khí hidro + oxit sắt từ (Fe3O4) → Sắt + Nước
4H2 + Fe3O4 → 3Fe + 4H2O
3) Kẽm + axit clohiđric → kẽm clorua + hidro
Zn + 2HCl → ZnCl2 + H2
4) Canxi cacbonat + axit clohidric → canxi clorua + nước + khí cacbonic
CaCO3+ 2HCl → CaCl2 + H2O + CO2
5) Sắt + đồng (II) sunfat → Sắt (II) sunfat + đồng
Fe + CuSO4 → FeSO4 + Cu
c. Chọn CTHH thích hợp đặt vào những chỗ có dấu chấm hỏi và cân bằng các phương trình hóa học sau:
1) CaO + HCl → ? + H2
2) P + ? → P2O5
3) Na2O + H2O →?
4) Ba(NO3)2 + H2SO4 → BaSO4 + ?
5) Ca(HCO3)2 → CaCO3 + CO2 + ?
6) CaCO3 + HCl → CaCl2 + ? + H2O
7) NaOH + ? → Na2CO3 + H2O
Lời giải chi tiết:
1) CaO + 2HCl → CaCl2+ H2
2) 4P + 5O2 → 2P2O5
3) Na2O + H2O → 2NaOH
4) Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
5) Ca(HCO3)2 → CaCO3 + CO2 + H2O
6) CaCO3 + 2HCl → CaCl2 + CO2 + H2O
7) 2NaOH + CO2 → Na2CO3 + H2O
d. Cân bằng các phương trình hóa học sau chứa ẩn
1) FexOy + H2 → Fe + H2O
2) FexOy + HCl → FeCl2y/x + H2O
3) FexOy + H2SO4 → Fe2(SO4)2y/x + H2O
4) M + H2SO4 → M2(SO4)n + SO2 + H2O
5) M + HNO3 → M(NO3)n + NO + H2O
6) FexOy + H2SO4 → Fe2(SO4)2y/x + SO2 + H2O
Lời giải chi tiết:
1) FexOy + H2 → Fe + H2O
2) FexOy + 2y HCl→ x FeCl2y/x+ y H2O
3) 2FexOy + (6x – 2y) H2SO4 → xFe2(SO4)3 + (3x – 2y) SO2+ (6x – 2y) H2O
4) 2FexOy + (6x – 2y) H2SO4 → xFe2(SO4)3 + (3x – 2y) SO2 + (6x – 2y) H2O
5) (5x – 2y) M + (6nx – 2ny) HNO3 → (5x – 2y)M(NO3)n + nNxOy + (3nx – ny)H2O
6) FexOy + 2y H2SO4 → x Fe2(SO4)2y/x + 2y H2O

2. Tính theo phương trình hóa học
Để làm tốt dạng bài này, bạn cần ghi nhớ các công thức hóa học lớp 8 sau đây:
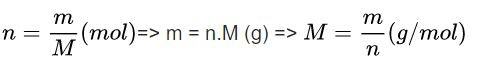
Trong đó:
- n: số mol của chất (mol)
- m: khối lượng (gam)
- M: Khối lượng mol (gam/mol)
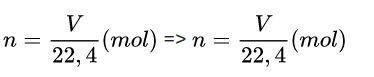
Trong đó:
- V: thể tích chất (điều kiện chuẩn) (lít)
3. Bài toán về lượng chất dư
Giả sử có phản ứng hóa học: aA + bB → cC + dD.
Cho nA là số mol chất A, và nB là số mol chất B
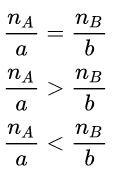
→ A và B là 2 chất phản ứng hết (vừa đủ)
→ Sau phản ứng thì A còn dư và B đã phản ứng hết
→ Sau phản ứng thì A phản ứng hết và B còn dư
Tính lượng các chất theo chất phản ứng hết.
Ví dụ: Cho 6,5 gam kẽm tác dụng với 36,5 g dung dịch HCl. Tính khối lượng muối tạo thành sau phản ứng.
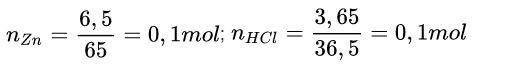
Zn + 2HCl → ZnCl2 + H2
Theo phương trình: 1 mol 2 mol 1 mol
Theo đầu bài : 0,1 mol 0,1 mol 0,05 mol
Xét tỉ lệ:
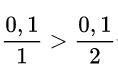
→ Zn dư, Khối lượng các chất tính theo lượng HCl
![]()
Dung dịch và nồng độ dung dịch
1. Các công thức cần ghi nhớ
a. Độ tan
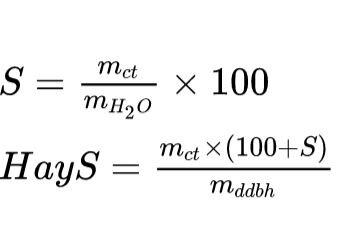
b. Nồng độ phần trăm dung dịch (C%)
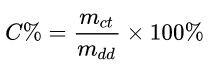
Trong đó:
- mct: khối lượng chất tan (gam)
- mdd: khối lượng dung dịch (gam)
Ví dụ: Hòa tan 15 gam muối vào 50 gam nước. Tình nồng độ phần trăm của dung dịch thu được.
Lời giải chi tiết:
Ta có: mdd = mdm + mct = 50 + 15 = 65 gam
Áp dụng công thức:
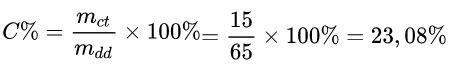
c. Nồng độ mol dung dịch (CM)
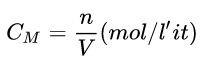
Ví dụ: Tính nồng độ mol của dung dịch khi 0,5 lit dung dịch CuSO4 chứa 100 gam CuSO4
Lời giải chi tiết:
Số mol của CuSO4 = 100 : 160 = 0,625 mol
Nồng độ mol của dung dịch CuSO4 = 0,625 : 0,5 = 1,25M
d. Công thức liên hệ giữa D (khối lượng riêng), mdd (khối lượng dung dịch) và Vdd (thể tích dung dịch):
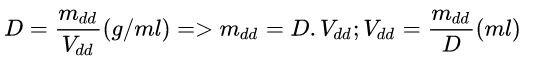

Dưới đây là một số dạng bài tập cơ bản. Mời bạn tham khảo nhé!
Dạng 1: Bài tập về độ tan
Bài tập 1: Ở 20oC, 60 gam KNO3 tan trong 190 nước thì thu được dung dịch bão hoà. Tính độ tan của KNO3 ở nhiệt độ đó ?
Lời giải:
Cứ 190 gam H2O hòa tan hết 60 gam KNO3 tạo dung dịch bão hòa.
100 gam H2O hòa tan hết x gam KNO3.
SKNO3 = (100.60)/190 = 31,58.
Bài tập 2: Ở 20oC, độ tan của K2SO4 là 11,1 gam. Phải hoà tan bao nhiêu gam muối này vào 80 gam nước thì thu được dung dịch bão hoà ở nhiệt độ đã cho?
Lời giải:
20oC: 100g nước hòa tan tối đa 11,1g K2SO4.
Vậy 80 gam nước hòa tan tối đa là:
Số gam muối cần hòa tan: (80.11,1)/100 = 8,88 gam.
Bài tập 3: Tính khối lượng KCl kết tinh được sau khi làm nguội 600 gam dung dịch bão hoà ở 80oC xuống 20oC. Biết độ tan S ở 80oC là 51 gam, ở 20oC là 34 gam.
Lời giải:
Ở 80oC, độ tan của KCl là 51 gam:
151 gam dung dịch bão hòa chứa 51 gam KCl.
⇒ 604 gam → 204 gam
Đặt khối lượng KCl tách ra là a gam.
Ở 20oC, độ tan của KCl là 34 gam:
134 gam dung dịch bão hòa chứa 34 gam KCl.
604 – a gam 204 – a gam
⇒ 34.(604 – a) = 134.(204 – a) ⇒ a = 68 gam
Vậy khối lượng KCl kết tinh được là 68 gam.
Dạng 2: Pha trộn dung dịch xảy ra phản ứng giữa các chất tan với nhau hoặc phản ứng giữa chất tan với dung môi → Ta phải tính nồng độ của sản phẩm (không tính nồng độ của chất tan đó).
Ví dụ: Khi cho Na2O, CaO, SO3,… vào nước, xảy ra phản ứng như sau:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Bài tập 1: Cho 6,2 gam Na2O vào 73,8 gam nước thu được dung dịch A. Tính nồng độ của chất có trong dung dịch A?
Lời giải:
nNa2O = 6,2/62 = 0,1 mol
Phương trình hóa học
Na2O + H2O → 2NaOH
0,1 → 0,2 (mol)
mNaOH= 0,2.40 = 8 gam
mdd A = mNa2O + mnước = 6,2 + 73,8 = 80 gam
→ C% NaOH (dd A) = 8/80 .100% = 10%
Bài tập 2: Cho 6,2 gam Na2O vào 133,8 gam dung dịch NaOH có nồng độ 44,84%. Tính nồng độ phần trăm của chất có trong dung dịch?
Lời giải:
nNa2O= 6,2/62 = 0,1 mol
Phương trình hóa học
Na2O + H2O → 2NaOH
⇒nNaOH tạo ra = 0,1.2 = 0,2 mol
nNaOH = (133,8.44,84)/(100.40) = 1,5 mol
⇒nNaOH = 1,5 + 0,2 = 1,7 mol
Theo định luật bảo toàn khối lượng: mNa2O + mdd NaOH = mdd spu = 6,2 + 133,8 = 140 gam
⇒ C%dd = (1,7.40)/140⋅100% = 48,6%

Bài viết trên đây của Chúng Tôi đã tổng hợp các công thức hóa học lớp 8 chi tiết, đầy đủ nhất. Hy vọng sẽ giúp ích cho bạn trong quá trình học tập. Hẹn gặp bạn ở bài viết sau!
Tổng hợp công thức hóa học lớp 8 là một khía cạnh quan trọng trong quá trình học tập của học sinh. Việc nắm vững và hiểu rõ các công thức hóa học giúp học sinh dễ dàng áp dụng, tính toán và giải quyết các bài tập hóa học.
Trước hết, công thức hóa học cung cấp thông tin về cấu trúc của các chất. Nó cho biết nguyên tử và tỉ lệ của các nguyên tử trong một phân tử, từ đó giúp ta hiểu được tính chất và tính chất hóa học của chất đó. Các công thức hóa học cũng cung cấp thông tin về trạng thái của chất (rắn, lỏng, khí) và giúp ta hiểu quá trình biến đổi chất trong các phản ứng hóa học.
Đối với học sinh lớp 8, việc học và nắm vững các công thức hóa học đóng vai trò quyết định trong việc xây dựng cơ sở kiến thức hóa học. Từ việc nắm vững và hiểu rõ các công thức, học sinh có thể áp dụng vào giải quyết các bài tập hóa học và giải thích các hiện tượng hóa học xảy ra trong cuộc sống hàng ngày.
Ngoài ra, việc tổng hợp công thức hóa học cũng đòi hỏi kỹ năng quan sát, phân tích và tư duy logic của học sinh. Quá trình học tập này giúp phát triển khả năng tư duy khoa học, sự chính xác và cẩn thận trong công việc. Nếu học sinh rèn kỹ năng này từ những năm học đầu tiên, họ sẽ trở nên thành thạo và tự tin hơn trong việc tiếp cận những kiến thức hóa học phức tạp hơn ở các lớp sau.
Tổng hợp công thức hóa học lớp 8 đòi hỏi điều kiện học tập tốt, sự chăm chỉ và kiên nhẫn từ học sinh. Đồng thời, nó đòi hỏi sự hỗ trợ và ảnh hưởng tích cực từ giáo viên và gia đình. Sự kết hợp này giúp học sinh có môi trường học tập thuận lợi và đạt được hiệu quả cao trong việc nắm vững các công thức hóa học.
Tổng kết lại, việc tổng hợp công thức hóa học lớp 8 có ý nghĩa quan trọng trong việc xây dựng cơ sở kiến thức hóa học cho học sinh. Nắm vững và hiểu rõ các công thức hóa học giúp học sinh phát triển năng lực và tự tin hơn trong việc áp dụng, tính toán và giải quyết các bài tập hóa học. Đồng thời, việc học công thức hóa học còn góp phần phát triển các kỹ năng quan sát, phân tích và tư duy logic của học sinh, từ đó khẳng định vai trò quan trọng của hóa học trong cuộc sống hàng ngày.
Cảm ơn bạn đã xem bài viết Tổng hợp công thức hóa học lớp 8 chi tiết nhất tại thcshuynhphuoc-np.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Công thức hóa học
2. Phân tử
3. Nguyên tử
4. Tổng hợp
5. Lớp học 8
6. Phân tử hợp chất
7. Công thức hóa học đơn giản
8. Công thức phân tử
9. Công thức hoá học phân tử
10. Cách xác định công thức hóa học
11. Bước xác định công thức hóa học
12. Công thức cấu tạo
13. Phân tử hóa chất
14. Cách xây dựng công thức hóa học
15. Công thức hợp chất.


