Bạn đang xem bài viết Tổng hợp các công thức hóa học lớp 10 đầy đủ, chi tiết nhất tại thcshuynhphuoc-np.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Công nghệ hóa học đã và đang phát triển vượt bậc, mở ra nhiều cánh cửa mới cho con người trong việc tìm hiểu và ứng dụng trong cuộc sống hàng ngày. Trong quá trình học tập môn hóa học lớp 10, chúng ta được tiếp cận với nền tảng kiến thức cơ bản, một số công thức quan trọng đã và đang được ứng dụng rộng rãi.
Việc nắm vững các công thức hóa học trong lớp 10 có thể đáp ứng một phần nhu cầu sử dụng kiến thức hóa học trong cuộc sống hàng ngày và mở ra nhiều cánh cửa mới trong lĩnh vực nghiên cứu và ứng dụng. Tuy nhiên, việc tổng hợp và nắm vững các công thức này đôi khi gặp khó khăn do sự phong phú và chi tiết của chúng.
Để giúp các em học sinh lớp 10 nắm vững kiến thức hóa học cơ bản, chúng tôi xin tổng hợp và trình bày các công thức hóa học lớp 10 đầy đủ và chi tiết nhất trong bài viết này. Bài viết được chia thành các mục tương ứng với các chủ đề trong sách giáo trình, giúp các em dễ dàng tiếp cận và hiểu rõ hơn về từng khái niệm và công thức.
Từ những công thức đơn giản như công thức hay phản ứng hóa học, công thức tính toán nồng độ, đến các khái niệm về cấu trúc hạt nhân và electron của các nguyên tử, chúng tôi sẽ chi tiết trình bày cách tính toán và ứng dụng trong thực tế để giúp các em hiểu rõ hơn về công thức hóa học lớp 10.
Hy vọng rằng bài viết này sẽ giúp các em nắm vững kiến thức hóa học cơ bản và áp dụng vào cuộc sống hàng ngày. Qua việc hiểu rõ về các công thức và khái niệm, các em sẽ có cơ hội phát triển khả năng tư duy logic, kỹ năng giải quyết vấn đề và làm việc trong các lĩnh vực liên quan đến hóa học.
Trong bài viết hôm nay, Chúng Tôi mang đến cho bạn đọc những kiến thức về các công thức hóa học lớp 10 đầy đủ, chi tiết nhất. Hy vọng đây sẽ là cuốn sổ tay công thức giúp bạn học tốt môn Hóa học lớp 10 nhé!
Các công thức hóa học lớp 10 đầy đủ, chi tiết nhất
Nội dung chương trình Hóa học lớp 10 có khá nhiều kiến thức và công thức cần nhớ khiến bạn phải đau đầu. Vì thế, Chúng Tôi sẽ giúp bạn tổng hợp các công thức hóa học lớp 10 trong từng chương một cách đầy đủ, chi tiết nhất.
Chương 1: Nguyên tử
Công thức đầu tiên trong nội dung các công thức hóa học lớp 10 đó là công thức tính nguyên tử. Thành phần cấu tạo nguyên tử gồm hạt nhân (số Proton + số Nơtron ) và vỏ nguyên tử (Electron).
Ký hiệu nguyên tử
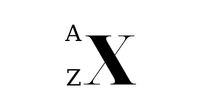
Trong đó:
- X là kí hiệu hóa học.
- A là số khối (số Proton + số Nơtron).
- Z là số hiệu nguyên tử.
Công thức tính
Số đơn vị điện tích hạt nhân:
- Z = số proton (P) = số electron (E)
- Z = P = E
Số khối của hạt nhân:
- A = Số proton (Z) + số nơtron (N)
- A = Z + N
Tổng các hạt trong nguyên tử = P + E + N
Công thức tính nguyên tử khối trung bình:
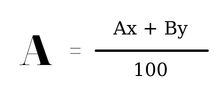
Trong đó:
- A, B lần lượt là nguyên tử khối của hai đồng vị A và B
- x, y lần lượt là tỉ lệ phần trăm số nguyên tử của mỗi đồng vị A và B.
Cách xác định phần trăm các đồng vị:
- Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
Công thức tính thể tích nguyên tử:
V = 4/3πr³ (r là bán kính nguyên tử)
Khối lượng riêng của nguyên tử:
D = m/V
- 1 mol nguyên tử chứa N = 6,023 x 10 mũ 23 nguyên tử.
Chương 2: Bảng tuần hoàn các nguyên tố hóa học – Định luật tuần hoàn
Trước khi tìm hiểu các công thức hóa học lớp 10 trong chương 2, chúng ta cùng hệ thống lại kiến thức về vị trí nguyên tố trong bảng tuần hoàn nhé!
Vị trí nguyên tố trong bảng tuần hoàn
- Số thứ tự ô bằng số hiệu nguyên tử bằng số proton bằng số electron.
- Số thứ tự chu kì bằng số lớp electron.
- Số thứ tự nhóm bằng số electron hóa trị.
Các công thức tạo bởi nguyên tố R, thuộc nhóm nA trong bảng tuần hoàn
- Công thức oxit cao nhất:
- R2On
- Với n là số thứ tự của nhóm.
- Công thức hợp chất khí với hydro:
- RH8- n
- Với n là số thứ tự của nhóm.
Trong cùng chu kỳ, khi điện tích hạt nhân tăng, hóa trị cao nhất với oxi tăng từ 1 đến 7, hóa trị đối với hydro giảm từ 4 đến 1.
Chương 3: Liên kết hóa học
Các công thức hóa học lớp 10 trong chương 3 – Liên kết hóa học gồm:
Hiệu độ âm điện và liên kết hóa học
Xét hợp chất có CTHH dạng AxBy
Hiệu độ âm điện:
ΔxA – B = |xA – xB|
Nếu:
- 0 ≤ ΔxA – B < 0,4: Liên kết cộng hóa trị không cực.
- 0,4 ≤ ΔxA – B < 1,7: Liên kết cộng hóa trị có cực.
- ΔxA – B ≥ 1,7: Liên kết ion.
Cách xác định số oxi hóa
- Quy tắc 1: Số oxi hóa của các nguyên tố trong các đơn chất bằng 0 (VD: H2, O2, N2,…).
- Quy tắc 2: Trong 1 phân tử, tổng số oxi hóa của các nguyên tố bằng 0.
- Quy tắc 3: Các ion đơn nguyên tử có số oxi hóa bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tố bằng điện tích của ion.
- Quy tắc 4: Trong hợp chất, số oxi hóa của Hydro bằng +1 (trừ trường hợp như hydrua, kim loại như NaH, CaH2,… có số oxi hóa bằng −1). Số oxi hóa của Oxy bằng −2 (trừ trường hợp F2O, peoxit như H2O2, Na2O2).
Chương 4: Phản ứng oxi hóa – khử
Phản ứng oxi hoá – khử là phản ứng hoá học mà ở đó đó có sự chuyển electron giữa các chất tham gia vào phản ứng. Hay nói cách khác, đây là phản ứng có sự thay đổi số oxi hoá của một số nguyên tố.
Vậy các công thức hóa học lớp 10 trong phản ứng oxi hóa – khử là gì, cùng Chúng Tôi khám phá ngay nào.
Định luật bảo toàn electron
∑ne nhường = ∑ne nhận
Cân bằng phương trình phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron
- Bước 1: Xác định số oxi hóa và ghi số oxi hoá của những nguyên tố có số oxi hoá thay đổi.
- Bước 2: Viết phương trình phản ứng và cân bằng.
- Bước 3: Tìm hệ số thích hợp của chất oxi hóa và chất khử sao cho tổng số electron nhường bằng với tổng số electron nhận.
Chương 5: Nhóm halogen
Nhóm halogen thuộc nhóm VII A trong bảng tuần hoàn các nguyên tố hóa học. Nhóm halogen gồm các nguyên tố Clo (Cl), Flo (F), Brom (Br) và Iot (I).
Công thức tính khối lượng muối thu được khi cho kim loại phản ứng hết với HCl:
m muối = m KL + m gốc axit
Công thức tính khối lượng muối clorua thu được khi toàn tan hết hỗn hợp kim loại bằng HCl giải phóng H2:
m muối clorua = m hỗn hợp KL + 71.nH2
Chương 6: Oxi – Lưu huỳnh
Các công thức hóa học lớp 10 chương Oxi – Lưu huỳnh gồm:
- Khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp kim loại bằng H2SO4 loãng giải phóng H2:
m muối sunfat = m hỗn hợp KL + 96.nH2
- Khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp oxit kim loại bằng H2SO4 loãng:
m muối sunfat = m hỗn hợp KL + 80.nH2SO4
- Khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2:
m muối = m hỗn hợp KL + 96.nSO2
- Khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2, S, H2S:
m muối = m hỗn hợp KL + 96.(nSO2 + 3nS + 4nH2S)
Chương 7: Tốc độ phản ứng – Cân bằng hóa học
Tốc độ phản ứng
Tốc độ phản ứng là sự thay đổi (độ biến thiên) nồng độ của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
Xét một phản ứng có sự tham gia của chất A từ thời điểm t1 đến t2.
Tốc độ phản ứng của A là:
Δv = – ΔC/Δt
Trong đó:
- ΔC: Độ biến thiên nồng độ của chất (lấy trị tuyệt đối)
- Δt: Khoảng thời gian xảy ra sự biến thiên nồng độ.
Nếu tốc độ phản ứng tính theo sản phẩm B thì:
v = ΔC/Δt
Do đó, công thức tổng quát tính tốc độ phản ứng trong khoảng thời gian từ t1 đến t2:
v = ± ΔC/Δt
Biểu thức vận tốc phản ứng:
v = k.[A]a.[B]b
Trong đó:
- k: Hằng số tỉ lệ (hằng số vận tốc).
- [A], [B]: Nồng độ mol chất A, B
Độ biến thiên nồng độ (ΔC) của các chất trong phản ứng có thể khác nhau. Tốc độ phản ứng của từng chất có thể khác nhau.
Cân bằng hóa học
Xét phản ứng thuận nghịch: aA + bB ↔ cC + dD, ta có:
- Phản ứng thuận: A + B → C + D.
- Phản ứng nghịch: C + D → A + B.
Phản ứng ở trạng thái cân bằng:
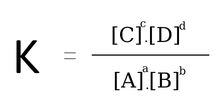
Lưu ý: Đối với phản ứng có chất rắn thì không viết nồng độ chất rắn vào biểu thức tính K.
Như vậy, Chúng Tôi đã giúp bạn củng cố các công thức hóa học lớp 10. Ngoài việc nắm vững các kiến thức về mặt lý thuyết thì việc rèn luyện các bài tập vận dụng là điều thiết yếu. Cùng Chúng Tôi giải một số bài tập vận dụng ngay nào.

Xem thêm:
- M là gì trong Hóa học? Một số công thức liên quan đến m và M
- N là gì trong Hóa học? Các ký hiệu trong công thức Hóa học
- C là gì trong Hóa học? Tổng hợp các công thức liên quan
Bài tập vận dụng các công thức hóa học lớp 10
Bài 1: Tổng số hạt cơ bản của 1 nguyên tử X là 82, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 22. Xác định X.
Hướng dẫn giải:
Ta có: P + N + E = 82
⇒ 2P + N = 82 (1) (Vì P = E)
Mà tổng số hạt mang điện nhiều hơn số hạt không mang điện là 22, nên
2P – N = 22 (2)
Từ (1) và (2) ⇒ P = E = 26, N = 30
⇒ A = P + N = 56
Vậy X là Fe
Bài 2 Khi đun nóng 11,07g KMnO4 ta được 10,11g bã rắn A và chất khí B. Tính thể tích B ở (đktc) được giải phóng?
Hướng dẫn giải:
PTHH: KMnO4 → K2MnO4 + MnO2 + O2
Áp dụng định luật bảo toàn khối lượng:
mB = 11,07 – 10,11 = 0,96 (g) = mO2
nO2 = m/M = 0,96/32 = 0,03 (mol)
VO2 = n x 22,4 = 0,03 x 22,4 = 0,672 (lít)
Bài 3: Hòa tan hoàn toàn 19,2 gam Cu bằng dung dịch HNO3 thu được V lít khí NO ở đktc (NO là sản phẩm khử duy nhất). Tìm giá trị của V.
Hướng dẫn giải:
nCu = 19,2/64 = 0,3 (mol)
Ta có:
Cu (0) → Cu(+2) + 2e
N(+5) + 3e → N(+2)
Cứ 1 mol Cu sẽ nhường 2e, do đó 0,3 mol Cu sẽ nhường 0,3 x 2 = 0,6 mol
Giải sử số mol NO cần tìm là X thì số e để tạo ra X mol NO là 3X
Áp dụng định luật bảo toàn electron:
∑ne nhường = ∑ne nhận ⇔ 0,6 = 3X ⇒ X = 0,2
⇒ V = 0,2 x 22,4 = 4,48 (lít)
Bài 4: Hòa tan hết 11,1 gam hỗn hợp 3 kim loại trong dung dịch H2SO4 loãng dư thu được dung dịch A và 8,96 lít khí ở đktc. Cô cạn dung dịch A được m gam muối khan. Tính m?
Hướng dẫn giải:
Theo đề ta có:
nH2 = V/22,4 = 8,96/22,4 = 0,4 (mol)
Áp dụng công thức: m muối = mKL + 96.nH2 = 11,1 + 96.0,4 = 11,1 + 38,4 = 49,5 (g)

Trên đây là tất cả các công thức hóa học lớp 10 mà Chúng Tôi chia sẻ với bạn. Hy vọng các công thức hóa học lớp 10 sẽ là bước đệm giúp bạn tiếp thu kiến thức mới trong lớp 11 tốt hơn. Chúc các bạn học tốt và đừng quên theo dõi Chúng Tôi mỗi ngày nhé!
Trong bài viết này, chúng ta đã tổng hợp và giới thiệu một số công thức hóa học lớp 10 đầy đủ, chi tiết nhất. Như chúng ta đã thấy, hóa học đóng vai trò quan trọng trong đời sống hàng ngày. Việc hiểu và áp dụng công thức hóa học không chỉ giúp chúng ta hiểu rõ về cấu trúc và tính chất của chất liệu, mà còn giúp chúng ta giải quyết các vấn đề khó khăn trong cuộc sống.
Chúng ta bắt đầu bằng việc tìm hiểu và áp dụng công thức hóa học cơ bản như công thức hóa học của các chất đơn giản như nước, muối và các chất hữu cơ cơ bản. Chúng ta đã tìm hiểu về cách viết các công thức phân tử và công thức hợp chất của các chất này, và hiểu rõ về cấu trúc và tính chất của chúng.
Chúng ta cũng đã tiếp cận với các phương trình hóa học, nơi chúng ta học cách cân bằng phương trình và giải quyết các vấn đề liên quan đến phản ứng hóa học. Điều này đã giúp chúng ta hiểu rõ hơn về quy trình xảy ra trong một phản ứng hóa học và cách thay đổi nguyên tử và liên kết trong quá trình này.
Ngoài ra, chúng ta cũng đã nắm vững cách tính toán và áp dụng các công thức và quy tắc hóa học để giải quyết các vấn đề liên quan đến khối lượng chất, dung dịch và nồng độ chất.
Cuối cùng, chúng ta đã khám phá các khái niệm về phản ứng oxi-hoá khử và hiểu rõ về cấu trúc và tính chất của các chất oxi-hoá và khử. Chúng ta đã học cách viết và cân bằng các phương trình oxi-hoá khử và biết rõ về quá trình xảy ra trong các phản ứng này.
Tổng hợp các công thức hóa học lớp 10 đầy đủ và chi tiết nhất giúp chúng ta xây dựng nền tảng vững chắc về hóa học. Điều này sẽ hỗ trợ chúng ta trong việc giải quyết các bài toán hóa học cơ bản và phức tạp hơn trong tương lai. Việc áp dụng kiến thức hóa học vào cuộc sống hàng ngày cũng sẽ giúp chúng ta hiểu rõ hơn về thế giới xung quanh và đóng góp vào việc tạo ra những sản phẩm và giải pháp hữu ích cho xã hội.
Cảm ơn bạn đã xem bài viết Tổng hợp các công thức hóa học lớp 10 đầy đủ, chi tiết nhất tại thcshuynhphuoc-np.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Alpha-kétoglutaric acid
2. Benzenecarboxylic acid
3. Butanoic acid
4. Carbonic acid
5. Cetyl alcohol
6. Ethanoic acid
7. Ethyl alcohol
8. Glacial acetic acid
9. Hexanoic acid
10. Isovaleric acid
11. Methyl alcohol
12. Octanoic acid
13. Propanoic acid
14. Salicylic acid
15. Stearic acid


