Bạn đang xem bài viết Các công thức Hóa học lớp 9? Một số bài tập điển hình tại thcshuynhphuoc-np.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Hóa học là một môn học quan trọng và thú vị trong chương trình giảng dạy trung học cơ sở. Qua việc nghiên cứu về cấu trúc và tính chất của chất, chúng ta có thể hiểu rõ hơn về sự tạo thành và phản ứng của các hợp chất trong tự nhiên và xã hội. Trong lớp 9, học sinh được giới thiệu với các công thức hóa học cơ bản, đó là công cụ quan trọng để tìm hiểu và giải quyết các bài tập và vấn đề liên quan đến hóa học.
Một số bài tập điển hình trong chương trình hóa học lớp 9 mà học sinh thường gặp phải có thể bao gồm việc tính khối lượng mol, phân tích phần trăm thành phần các nguyên tố trong hợp chất, cân bằng phương trình hóa học và tính toán thể tích khí trong các phản ứng hóa học. Những bài tập này đòi hỏi học sinh áp dụng kiến thức về công thức hóa học và quy tắc tính toán để tìm ra câu trả lời chính xác.
Tuy nhiên, việc học công thức hóa học không chỉ đơn thuần là việc nhớ và áp dụng, mà còn cần hiểu rõ về ý nghĩa và cơ sở lý thuyết sau đó. Đây là một điểm mạnh của việc học hóa học lớp 9, khi học sinh có thể kết hợp kiến thức với thực tế và ứng dụng vào cuộc sống hàng ngày.
Với sự hỗ trợ của giáo viên và tài liệu giảng dạy, học sinh lớp 9 có thể rèn luyện kỹ năng về công thức hóa học và giải quyết các bài tập điển hình. Qua việc thực hành và tìm hiểu sâu hơn về hóa học, học sinh sẽ phát triển sự tư duy logic và khả năng giải quyết vấn đề, từ đó đóng góp vào sự thành công trong việc học và làm việc trong tương lai.
Để có thể làm tốt được tất cả các dạng bài tập về Hóa học lớp 9 thì các bạn cần phải nắm rõ toàn bộ các công thức liên quan đến phần kiến thức các bạn đã học. Vậy các công thức Hóa học lớp 9 bao gồm những gì? Cùng Chúng Tôi tìm hiểu ngay sau đây để học tốt hơn bạn nhé!
Tóm tắt các công thức Hóa học lớp 9
Chương 1: Các loại hợp chất vô cơ
Bài toán CO2, SO2 dẫn vào dung dịch kiềm là NaOH, KOH
Khi ta cho CO2 (hoặc SO2) tác dụng với dung dịch kiềm là NaOH thì sẽ xảy ra những khả năng tạo muối như sau:
CO2 + 2NaOH → Na2CO3 + H2O (1)
CO2 + NaOH → NaHCO3 (2)
Đặt T = nNaOH / nCO2
Nếu T = 2: chỉ tạo ra muối Na2CO3 (muối trung hòa)
Nếu T ≤ 1: chỉ tạo ra muối NaHCO3 (muối axit)
Nếu 1 < T < 2: tạo ra cả muối NaHCO3 và Na2CO3 (muối axit và muối trung hòa)
Bài toán CO2, SO2 dẫn vào dung dịch kiềm Ca(OH)2, Ba(OH)2
Ta có phương trình phản ứng hóa học sau:
Ca(OH)2 + CO2 → CaCO3↓ + H2O (1)
Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2)
Sau đó:
Đặt T = nCO2 / nCa(OH)2
Nếu T ≤ 1: chỉ tạo ra muối CaCO3
Nếu T = 2: chỉ tạo ra muối Ca(HCO3)2
Nếu 1 < T < 2: tạo ra cả muối CaCO3 và Ca(HCO3)2
Ví dụ: Dẫn 2,24 lít khí CO2 vào dung dịch chứa 0,2 mol NaOH. Dung dịch thu được sau phản ứng là gì?
Bài giải:
Ta có: nCO2 = 2,24 / 22,4 = 0,1 mol
T = nNaOH / nCO2 = 0,2 / 0,1 = 2
Vậy khi T = 2 thì sản phẩm thu được là Na2CO3.

Chương 2: Kim loại
Phương pháp tăng giảm khối lượng
A + B2(SO4)n → A2(SO4)m + B
Trong đó:
- A,B là kim loại
- B2(SO4)n, A2(SO4)m là muối
Ta có 2 trường hợp sẽ xảy ra:
- Trường hợp 1: mA (tan ra) < mB (bám vào)
m B (bám vào) – m A (tan ra) = m kim loại tăng
- Trường hợp 2: mA (tan ra) > mB (bám vào)
m A (tan ra) – m B (bám vào) = m kim loại giảm
Bảo toàn khối lượng
Tổng khối lượng các chất tham gia = Tổng khối lượng chất tạo thành.
Khối lượng thanh kim loại + khối lượng dung dịch = Khối lượng thanh kim loại mới + khối lượng dung dịch mới.
Phản ứng nhiệt nhôm:
nH2 = nFe + (3/2).nAl
nH2 = nFe + (3/2).nAl

Chương 3: Phi kim
Số hiệu nguyên tử
Một vài kiến thức liên quan đến số hiệu nguyên tử mà bạn cần nhớ như sau:
- STT ô nguyên tố = số hiệu nguyên tử = số proton = số electron.
- STT chu kì = số lớp electron.
- STT của các nhóm A = số electron ở lớp ngoài cùng của nguyên tử trong nhóm đó.
Các phản ứng của C, CO, H2
Trong các phản ứng của C, CO, H2 thì số mol của CO= nCO2, nC= nCO2 và nH2= nH2O.
Ta có các công thức cần nhớ sau:
- m bình tăng = m hấp thụ
- m dung dịch tăng = m hấp thụ – m kết tủa
- m dung dịch giảm = m kết tủa – m hấp thụ

Chương 4: Hidrocacbon
Công thức tính độ bất bão hòa
Xét hợp chất: CxHyOzNtXv (với X là các nguyên tố nhóm halogen)
Độ bất bão hòa: k = ( 2 + 2x – (y+v) +t ) /2
Công thức tính số C, số H trong hiđrocacbon (CxHy)
Số Cacbon = nCO2 / nCxHy
Số Hydro = 2nH2O / nCxHy
Công thức tính phân tử khối của hợp chất hữu cơ
Ví dụ hợp chất hữu cơ có dạng là CxHyOz thì phân tử khối của hợp chất hữu cơ có thể được tính theo những cách sau:
- Dựa vào khối lượng mol hợp chất hữu cơ: M = 12x + y + 16z (g/mol)
- Dựa vào công thức liên hệ giữa khối lượng và số mol: M = m/n
- Dựa vào tỉ khối: dA/B = MA/MB; dA/kk = MA/Mkk =MA/29
Sau đó chúng ta dựa vào phần trăm khối lượng của các nguyên tố: %mC/12 = %mH/1 = %mO/16 để lập công thức phân tử.

Tìm công thức phân tử bằng phản ứng cháy của hợp chất hữu cơ
Để tìm được công thức phân tử bằng phản ứng cháy của hợp chất hữu cơ thì ta làm theo các bước sau:
- Bước 1: Lập công thức tổng quát của hợp chất hữu cơ: CxHyOz.
- Bước 2: Chuyển đổi các đại lượng đầu bài cho thành số mol.
- Bước 3: Viết phương trình tổng quát của phản ứng cháy:
CxHyOz + (x +y/4 – z/2)O2 -> xCO2 + y/2 H2O
- Bước 4: Thiết lập tỉ lệ số mol các nguyên tố trong công thức
Tìm khối lượng mỗi nguyên tố như sau:
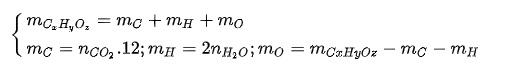
TH1: mCxHyOz = mC + mH => mO = 0, trong công thức phân tử chỉ có C và H (hidrocabon)
TH2: mO > 0, trong công thức phân tử có cả C, H, O
Tìm số mol nguyên tử của mỗi nguyên tố, thiết lập tỉ lệ số mol
![]()
- Bước 5: Biện luận công thức phân tử của hợp chất hữu cơ: M = (CxHyOz)n => n, M
Chương 5: Dẫn xuất của hidrocacbon – Polime
Công thức tính độ rượu
Độ rượu là số mol etylic có trong 100 ml hỗn hợp rượu với nước.
Công thức tính độ rượu như sau: (Vr / (Vr + VH2O)) / Vr
Trong đó:
- Vr: thể tích rượu nguyên chất.
- VH2O: thể tích nước có trong dung dịch

Xem thêm:
- N là gì trong Hóa học? Các ký hiệu trong công thức Hóa học
- C là gì trong Hóa học? Tổng hợp các công thức liên quan
- M là gì trong Hóa học? Một số công thức liên quan đến m và M
Một số bài tập điển hình
Để ghi nhớ lâu hơn các công thức Hóa học lớp 9 thì hãy cùng Chúng Tôi làm một vài bài tập sau đây nhé!
Bài tập 1:
Biết rằng 4,48 lít khí CO2 (ở đktc) tác dụng vừa đủ vơi 400ml NaOH tạo thành muối trung hòa.
a) Tính khối lượng muối thu được
b) Tính nồng độ mol của dung dịch NaOH đã dùng
Bài giải:
Sản phẩm tạo thành muối trung hòa là Na2CO3
Ta có phương trình hóa học của phản ứng như sau:
CO2 + 2NaOH → Na2CO3 + H2O
0,2→ 0,4 → 0,2
Số mol CO2: nCO2 = 0,2 mol
a) Khối lượng Na2CO3 tạo thành: mNa2CO3 = 0,2.106 = 21,2 gam
b) Nồng độ mol dung dịch NaOH đã dùng: CMNaOH = 0,4/0,4 = 1 M
Bài tập 2:
Trộn một dung dịch có hòa tan 0,2 mol CuCl2 với một dung dịch có hòa tan 20g NaOH. Lọc hỗn hợp các chất sau phản ứng, được kết tủa và nước lọc. Nung kết tủa đến khi khối lượng không đổi.
a) Viết các phương trình hóa học.
b) Tính khối lượng chất rắn thu được sau khi nung.
c) Tính khối lượng các chất có trong nước lọc.
Bài giải:
Ta có: nNAOH = 20/40 = 0.5 mol
a) Phương trình hóa học của phản ứng:
2NaOH + CuCl2 → Cu(OH)2 ↓ + 2NaCl (1)
Cu(OH)2 → CuO + H2O (2)
b) Khối lượng chất rắn thu được sau khi nung:
Theo phương trình (1):
nNaOH = 2nCuCl2 = 0,4 mol
nNaOH dư = 0,5 – 0,4 = 0,1 mol
Tính khối lượng chất rắn CuO, theo (1) và (2) ta có:
nCuO = nCu(OH)2 = nCuCl2 = 0,2 mol
mCuO = 0,2 x 80 = 16g.
c) Khối lượng các chất trong nước lọc:
Khối lượng NaOH dư: mNaOH = 0,1 x 40 = 4g
Khối lượng NaCl trong nước lọc:
nNaCl = nNaOH = 0,4 mol
mNaCl = 0,4 x 58,5 = 23,4g.
Bài tập 3:
Cho 9,2g một kim loại A phản ứng với khí clo dư tạo thành 23,4g muối. Hãy xác định kim loại A, biết rằng A có hóa trị I.
Bài giải:
Gọi nguyên tử khối của kim loại A là A.
Phương trình hóa học của phản ứng:
2A + Cl2 → 2ACl
mA = 9,2g, mACl = 23,4g.
Có nA = nACl
nA = 9,2 / A
nCl = 23,4 / (A + 35,5)
⇒ 9,2 x (A + 35,5) = A x 23,4.
⇒ A = 23. Vậy kim loại A là Na.
Bài tập 4:
Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dẫn khí X vào 500ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Bài giải:
Ta có nMnO2 = 69,6 / 87 = 0,8 mol
VNaOH = 500ml = 0,5 lít ⇒ nNaOH = CM. V= 0,5 x 4 = 2 mol
Phương trình phản ứng:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
Theo pt: nCl2 = nMnO2 = 0,8 mol.
Cl2 + 2NaOH → NaCl + NaClO + H2O.
Ta có tỉ lệ: 0,8/1 < 2/2 → NaOH dư nên tính nNaCl và nNaClO theo nCl2
Theo pt: nNaCl = nNaClO = nCl2 = 0,8 mol.
CM(NaCl)= CM(NaClO) = 0,8/0,5 = 1,6 mol/l.
Theo pt: nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6mol.
CM(NaOH) dư = (2 – 1,6) / 0,5 = 0,8 mol/l.
Bài tập 5:
Đốt cháy 3 gam chất hữu cơ A, thu được 8,8g khí CO2 và 5,4g H2O
a) Trong chất hữu cơ A có những nguyên tố nào?
b) Biết phân tử khối của A nhỏ hơn 40. Tìm công thức phân tử của A.
c) Chất A có làm mất màu dung dịch brom không?
d) Viết phương trình hóa học của A với clo khi có ánh sáng
Bài giải:
nCO2 = 8,8 / 44 = 0,2 mol.
⇒ Bảo toàn nguyên tố C: nC = nCO2 = 0,2 mol ⇒ mC = 0,2 × 12 = 2,4g.
nH2O = 5,4 / 18 = 0,3 mol.
Suy ra bảo toàn nguyên tố H: nH = 2nH2O = 0,6 mol ⇒ mH = 0,6 x 1 = 0,6g.
mC,H = 2,4 + 0,6 = 3g = mA có hai nguyên tố C và H. Vậy A là Hiđrocacbon
b) Đặt công thức phân tử của A là CxHy
x : y = mC/12 : mH /1 = 2,4/12 : 0,6/1 = 1:3
Vậy công thức phân tử của A có dạng (CH3)n vì MA < 40
→ (CH3)n < 40 ⇒ 15n < 40
• Nếu n = 1 ⇒ không hợp lý.
• Nếu n = 2 ⇒ Công thức phân tử của A là C2H6 (nhận)
c) A không làm mất màu dung dịch Br2.
d) C2H6 + Cl2 -> C2H5Cl + HCl
Bài tập 6:
Khi lên men dung dịch loãng của rượu etylic, người ta được giấm ăn.
a) Từ 10 lít rượu 8o có thể điều chế được bao nhiêu gam axit axetic? Biết hiệu xuất quá trình lên men là 92% và rượu etylic có D = 0,8 g/cm3.
b) Nếu pha khối lượng axit axetic trên thành dung dịch giấm 4% thì khối lượng dung dịch giấm thu được là bao nhiêu?
Bài giải:
a) Trong 10 lít rượu 80 thì có 10,8/100 = 0,8 lít rượu etylic
⇒ m rượu = V.D = 0,8.0,8.1000 = 640 (g)
Phương trình phản ứng lên men rượu:
C2H5OH + O2 → CH3COOH + H2O
nC2H5OH = 640/46 mol.
Theo PT: nCH3COOH = nC2H5OH = 640/46 mol
Khối lượng của axit: (640×60)/46 = 834,8 (g)
Vì hiệu suất quá trình lên men là 92% nên lượng axit có trong thực tế thu được:
maxit = 834,8. 92% = 768g
b) Khối lượng giấm thu được: m = (768 x 100) / 4 = 19200 g
Cách học nhanh các công thức Hóa học lớp 9
Nhìn chung các công thức Hóa học lớp 9 vẫn còn đang ở mức đơn giản. Vì vậy để học nhanh các công thức Hóa học lớp 9 thì bạn cần nắm vững các công thức Hóa học lớp 9 quan trọng.
Các bạn cũng có thể học các công thức Hóa học lớp 9 bằng việc tìm hiểu các bài hát hay các câu thơ liên quan đến các kiến thức đã học. Ví dụ như bài ca hóa trị, kí hiệu nguyên tố hóa học, thứ tự hoạt động của kim loại từ mạnh đến yếu,…
Ngoài ra, các để học nhanh các công thức Hóa học lớp 9 một cách hiệu quả nhất chính là hãy làm thật nhiều bài tập theo từng chương khác nhau. Điều này sẽ giúp bạn nhớ lâu các công thức Hóa học lớp 9 đấy nhé!

Trên đây là toàn bộ thông tin liên quan đến các công thức Hóa học lớp 9 và một số bài tập điển hình. Hy vọng bài viết này hữu dụng dành cho bạn. Hãy theo dõi Chúng Tôi mỗi ngày để biết thêm nhiều thông tin cũng như những kiến thức có ích nhé!
Các công thức hóa học lớp 9 đóng vai trò quan trọng trong việc xác định thành phần chất trong các phản ứng hóa học. Đây là kiến thức cơ bản và nền tảng để hiểu và áp dụng vào các bài tập thực tế.
Một số bài tập điển hình trong lớp 9 có thể bao gồm:
1. Tìm công thức hóa học của một hợp chất: Đây là một bài tập giúp học sinh hiểu cách xác định công thức của một chất dựa trên thông tin về tỉ lệ nguyên tố trong phân tử.
2. Điền công thức cho một phản ứng hóa học: Bài tập này giúp học sinh rèn kỹ năng làm việc với các biểu đồ phản ứng hoá học và xác định phương trình cân bằng.
3. Tính toán hỗn hợp chất: Bài tập này yêu cầu học sinh tính toán tỷ lệ phần trăm của các nguyên tố trong một hỗn hợp chất dựa trên công thức hóa học.
4. Giải thích hiện tượng hóa học: Yếu tố công thức hóa học cũng được sử dụng để giải thích các hiện tượng hóa học, như tại sao một phản ứng xảy ra hay tại sao một chất có tính chất nhất định.
Các công thức hóa học lớp 9 không chỉ giúp học sinh hình dung một cách cụ thể về cấu trúc của phân tử và hoạt động của chất, mà còn giúp cải thiện kỹ năng logic và phân tích. Qua việc thực hành các bài tập điển hình, học sinh sẽ làm quen với việc áp dụng các công thức hóa học để giải quyết các vấn đề thực tế và phát triển khả năng tư duy hóa học.
Cảm ơn bạn đã xem bài viết Các công thức Hóa học lớp 9? Một số bài tập điển hình tại thcshuynhphuoc-np.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Phản ứng hóa học
2. Công thức hóa học
3. Cấu tạo hạt nhân
4. Phân loại phản ứng hóa học
5. Phân tử hữu cơ
6. Sự liên kết hóa học
7. Sự oxi hoá – khử
8. Công thức cấu tạo
9. Sự tác dụng của các chất
10. Công thức thay đổi hóa học
11. Công thức phân tử
12. Phương trình hóa học
13. Công thức hóa trị
14. Chất điện phân
15. Sự chuyển hóa hóa học


