Bạn đang xem bài viết C là gì trong Hóa học? Tổng hợp các công thức liên quan tại thcshuynhphuoc-np.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Trong lĩnh vực hóa học, C là viết tắt của Carbon – một nguyên tố hóa học quan trọng và phổ biến nhất trên Trái Đất. Carbon là nguyên tố có số nguyên tử 6, thuộc nhóm 14 và chu kỳ 2 trong bảng tuần hoàn các nguyên tố. Với khối lượng nguyên tử trung bình là 12.01, carbon là nguyên tố nonmetallic có khả năng tạo thành nhiều hợp chất với các nguyên tố khác. Vì tính linh hoạt và sự kết hợp đa dạng của nó, carbon là một thành phần quan trọng trong hầu hết các hợp chất hữu cơ, mà là cơ sở của sự sống và hầu hết các vật chất được tạo thành từ sự sống.
Có rất nhiều công thức liên quan đến carbon. Trong hóa học hữu cơ, hợp chất cacbon được đặt tên thông qua công thức cấu trúc, biểu diễn sự liên kết giữa nguyên tử carbon và các nguyên tử khác. Các công thức này cung cấp thông tin về định hình và đặc tính của hợp chất. Ví dụ, công thức methane (CH₄) biểu thị cho một nguyên tử carbon liên kết với bốn nguyên tử hydrogen, trong khi công thức của ethane (C₂H₆) chỉ ra một chuỗi gồm hai nguyên tử carbon nối với sáu nguyên tử hydrogen.
Ngoài ra, các công thức liên quan đến carbon cũng bao gồm các hợp chất hữu cơ phổ biến như C₂H₅OH (etanol) – một dạng cồn, C₆H₁₂O₆ (glucose) – một đường đơn giản và tinh bột – một polysaccharide phổ biến. Các công thức này đại diện cho sự đa dạng và quan trọng của carbon trong hóa học và đóng vai trò quan trọng trong nhiều quá trình sinh hóa và công nghiệp.
Trong Hóa học, mỗi nguyên tố đều có ký hiệu riêng. Vậy C là gì trong Hóa học? Bài viết dưới đây của Chúng Tôi sẽ giúp bạn hiểu được khái niệm, các công thức hóa học liên quan để làm bài tập một cách tốt nhất nhé!
C là gì trong Hoá học?
C là gì trong Hoá học?
Trong bảng tuần hoàn các nguyên tố hóa học, C là ký hiệu của nguyên tố Carbon. C có số nguyên tử bằng 6 và nguyên tử khối bằng 12.
C là một nguyên tố phi kim có hóa trị 4 phổ biến. C tồn tại ở nhiều hình dạng đặc thù nhưng phổ biến nhất là ở dạng cacbon vô định hình, graphit, kim cương và Q – carbon.

C% là gì trong Hoá học?
Trong Hóa học, C% là ký hiệu của nồng độ phần trăm trong dung dịch. Nó cho ta biết số gam chất tan trong 100 gam dung dịch là bao nhiêu.
Với những kiến thức nêu trên, hẳn các bạn đã biết C là gì trong Hóa học. Vậy chúng ta cùng tiếp tục tìm hiểu công thức tính nồng độ phần trăm C ở phần tiếp theo của bài viết nhé!

Xem thêm:
- Z là gì trong Toán học? Tìm hiểu các tập hợp số cơ bản khác
- N là gì trong tiếng Anh? N là viết tắt từ gì trong tiếng Anh
Công thức tính nồng độ phần trăm C
Công thức tính nồng độ phần trăm của một chất được chia làm 2 loại đó là nồng độ phần trăm theo khối lượng và theo thể tích. Hãy cùng Chúng Tôi tìm hiểu ngay sau đây:
Công thức tính C% theo khối lượng
Nồng độ phần trăm theo khối lượng được định nghĩa là khối lượng của nguyên tố (hay chất tan) chia cho tổng khối lượng của hợp chất (hay dung dịch) và nhân với 100%.
Công thức tính nồng độ phần trăm:
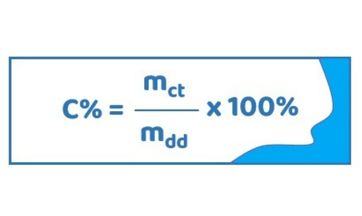
Trong đó,
- C%: Nồng độ phần trăm.
- mct: Khối lượng chất tan.
- mdd: Khối lượng dung dịch.
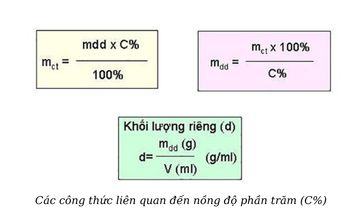
Công thức tính khối lượng dung dịch:
mdd = khối lượng dung môi + khối lượng chất tan
Công thức tính C% theo thể tích
Công thức tính nồng độ phần trăm theo thể tích được tính theo công thức sau:
Nồng độ phần trăm theo thể tích = thể tích chất tan chia cho tổng thể tích dung dịch, nhân với 100%.
Từ công thức tính nồng độ phần trăm, ta có thể suy ra một số công thức tính khác như sau:
Ví dụ: Hòa tan 15 gam NaCl vào 45 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
Ta có:
- mdd = khối lượng dung môi + khối lượng chất tan
Chất tan ở đây là NaCl và dung môi là nước
⇒ mdd = 15 + 45 = 60 gam
- Áp dụng công thức tính nồng độ phần trăm:
C% NaCl = mct / mdd x 100% = 15 / 60 x 100 = 25%
Những lưu ý khi tính nồng độ phần trăm của dung dịch
- Đọc thật kĩ đề bài để xác định được những thành phần đã cho, những thành phần cần phải tìm.
- Nhớ rõ công thức tránh tình trạng nhớ nhầm dẫn đến áp dụng sai.
- Tính toán thật cẩn thận để đưa ra kết quả đúng nhất.
- Nồng độ của dung dịch hầu hết được biểu thị bằng số mol chất tan có trong 1 lít dung dịch.
Bài tập tính nồng độ phần trăm (C%)
Sau đây Chúng Tôi sẽ hướng dẫn giải một số bài tập vận dụng tính nồng độ phần trăm (C%) để bạn nắm rõ bài hơn nhé!
Bài 1: Hòa tan hết 20 gam HCl vào trong 40 gam nước. Hãy tính nồng độ phần trăm của dung dịch này.
Hướng dẫn giải:
Ta có: HCl là chất tan, dung môi là nước.
Nên khối lượng dung dịch = mct + mdm = 20 + 40 = 60.
Áp dụng công thức: C% = mct / mdd x 100% = 20/60 x 100% = 33,3%.
Vậy nồng độ dung dịch của NaCl là 33,3%.
Bài 2: Tính khối lượng của NaOH có trong 200g dung dịch NaOH 15%.
Hướng dẫn giải:
Áp dụng công thức C% = mct / mdd x 100%, ta có:
C% = mNaOH / 200 x 100 = 15%.
⇒ mNaOH = C% x 200 / 100 = 30 (g).
Bài 3: Tính khối lượng H2SO4 có trong 150 gam dung dịch axit H2SO4 14%.
Hướng dẫn giải:
Ta có: C% = mct / mdd x 100%.
⇒ mct = C% x mdd /100%.
⇔ m(H2SO4) = 14 x 150/100 = 21 (g).
Bài 4: Hòa tan CaCO3 vào 200 gam dung dịch HCl 7,3% (vừa đủ).
a. Viết phương trình hóa học.
b. Tính nồng độ phần trăm của các chất có trong dung dịch sau phản ứng.
Hướng dẫn giải:
a. Phương trình hóa học: CaCO3 + 2HCl → CaCl2 + H2O + CO2↑.
b. Ta có: mHCl = (C% x mdd)/100% = 200 x 7,3/100 = 14,6 (gam).
⇒ nHCl = m/M = 14,6/36,5 = 0,4 mol.
⇒ nCaCO3 = nCaCl2 = nCO2 = ½nHCl = 0,2 mol.
⇒ mCaCO3 = n x M = 0,2 x 100 = 20 gam.
⇒ mCaCl2 = 0,2 x 111 = 22,2 gam, mCO2= 0,2 x 44 = 8,8 gam.
Khối lượng dung dịch sau phản ứng là:
mdd sau phản ứng = mCaCO3 + mdd HCl – mCO2 = 20 + 200 – 8,8 = 211,2 gam.
Vậy nồng độ của CaCl2 là: C% = (22,3 x 100%)/(211 x 2) = 10,51%.

Hy vọng với bài viết trên bạn đọc của Chúng Tôi đã biết được C là gì trong Hóa học. Trong quá trình học tập nếu có gì thắc mắc, đừng ngần ngại để lại câu hỏi ở phần bình luận, Chúng Tôi luôn sẵn sàng giải đáp giúp bạn. Chúc các bạn học tốt!
Trong lĩnh vực hóa học, C viết tắt cho hợp chất cacbon. Các nguyên tử cacbon chính là thành phần cơ bản của tất cả các hợp chất hữu cơ và là một trong những nguyên tố quan trọng nhất trong tự nhiên. Cacbon có khả năng tạo thành một loạt các liên kết hóa học và tương tác với các nguyên tử khác, điều này cho phép nó tạo ra hàng triệu hợp chất khác nhau và đóng vai trò quan trọng trong nhiều quá trình sinh học và công nghệ.
Có một số công thức hóa học quan trọng và phổ biến liên quan đến C. Công thức đơn giản nhất của cacbon là C, thể hiện nguyên tử cacbon đơn giản.
Cacbon thường hình thành các hợp chất hữu cơ phức tạp bằng cách tạo ra các liên kết hóa học với các nguyên tử khác. Một trong những loại liên kết phổ biến nhất của cacbon là liên kết đôi C=C, được biểu diễn bằng công thức hóa học C=C. Liên kết đôi này tạo ra nhóm chức unsaturated, có thể tham gia vào nhiều phản ứng hóa học khác nhau.
Cacbon cũng có khả năng tạo ra chuỗi dài các nguyên tử cacbon được kết nối bởi liên kết đơn C-C. Các chuỗi này tạo thành các hợp chất hữu cơ phổ biến như các hydrocarbon, các loại hợp chất dẫn xuất của cacbon như alkyl, halogen, aldehyde, ketone, acid… Các công thức liên quan như C2H6, CH3Cl, C2H4O, C3H6O… thể hiện cấu tạo và hợp chất của các phân tử chứa cacbon.
Sự hiện diện của cacbon trong hợp chất hữu cơ tạo nên độ phong phú và đa dạng của các hợp chất hóa học trong tự nhiên và công nghệ. Việc hiểu và ứng dụng các công thức hóa học liên quan đến C là rất quan trọng để nghiên cứu và phát triển các ứng dụng trong ngành hóa học và các lĩnh vực liên quan.
Cảm ơn bạn đã xem bài viết C là gì trong Hóa học? Tổng hợp các công thức liên quan tại thcshuynhphuoc-np.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. C (Carbon): Nguyên tố hóa học có ký hiệu C, số nguyên tử 6 trong bảng tử số.
2. Các nguyên tố liền kề như N (Nitơ), O (Oxy), H (Hydro), P (Phốtpho), S (Lưu huỳnh) có quan hệ mật thiết với C trong hóa học hữu cơ.
3. Có thể tạo ra hợp chất hữu cơ bằng cách kết hợp C với các nguyên tố khác.
4. C là thành phần chính của các hợp chất hữu cơ như carbohydrate, protein, lipid, và acid nucleic.
5. Có thể tạo ra hợp chất không hữu cơ như CO2 (carbon dioxide) từ C.
6. Kim loại sắt có thể tạo ra các hợp chất carbonitơ như Fe(CN)6 (hexacyanoferrate).
7. Bề mặt than hoạt tính, đặc biệt là than hoạt tính từ C, có khả năng hấp thụ các chất gây ô nhiễm và tác động lên môi trường.
8. Các hợp chất hữu cơ như các hydrocacbon có thể được sản xuất từ C qua quá trình cháy.
9. Quá trình điều chế hợp chất từ C thường cần có hiện diện của nguyên tố cọ (catalyst) như Ni (niken) hoặc Pt (platinum).
10. Các hợp chất có chứa C có thể tồn tại dưới dạng rắn, lỏng hoặc khí tùy thuộc vào bối cảnh và điều kiện xử lý.
11. Có thể xác định mật độ của C trong mẫu vật liệu bằng phương pháp đo khối lượng và khối lượng riêng.
12. Có thể tạo ra các polyme từ C, như polyethylene hoặc polystyrene, thông qua quá trình nối liền các đơn vị C.
13. Có thể điều chế các muối hợp chất của C, như sodium carbonate (Na2CO3) hoặc calcium carbonate (CaCO3).
14. C được sử dụng rộng rãi trong công nghiệp để chế tạo vật liệu như thép, chất bảo vệ và pin lithium-ion.
15. C được coi là một trong những nguyên tố quan trọng nhất trong hóa học do khả năng tạo ra vô số các hợp chất và sự tồn tại rộng rãi trong tự nhiên và các hệ sinh thái.


