Bạn đang xem bài viết 3 tính chất hóa học của ankan mà bạn cần phải nắm vững tại thcshuynhphuoc-np.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Ankan là một trong những dạng hợp chất hữu cơ cơ bản nhất và phổ biến nhất trong hóa học. Với các phân tử bền vững và tính chất đa dạng, ankan đã và đang chơi một vai trò quan trọng trong cuộc sống hàng ngày của chúng ta. Để hiểu rõ hơn về ankan, chúng ta cần nắm vững ba tính chất hóa học quan trọng sau đây: 1) Khả năng cháy: Ankan là một loại hợp chất dễ cháy, nghĩa là nó có khả năng reagiren với oxy trong không khí khi bị cháy để tạo ra nhiệt và ánh sáng. 2) Độ tan trong nước: Ankan là một loại hợp chất hydrophobic, có nghĩa là nó không giống như nước và không hoà tan hoàn toàn trong nước. Thay vào đó, ankan hòa tan tốt trong các dung môi hợp chất hữu cơ khác như n-hexan, benzen và các chất hữu cơ khác. 3) Tính trung tính: Ankan có tính chất hóa học trung tính, tức là nó không phản ứng dễ dàng với các chất reagent khác, bao gồm các chất oxi hóa và khử nhau. Tính chất này làm cho ankan trở thành một loại hợp chất ổn định và ít dễ bị biến đổi trong môi trường hóa học. Hiểu rõ ba tính chất hóa học này của ankan là rất quan trọng để có thể làm việc và sử dụng ankan một cách hiệu quả trong các ứng dụng của nó, từ nhiên liệu đến công nghiệp và y học.
Ankan là một nội dung quan trọng trong hóa học hữu cơ được dạy ở bậc trung học phổ thông. Nếu bạn chưa biết tính chất hóa học của ankan là gì thì đừng bỏ qua bài viết ngày của Chúng Tôi.
Ankan là gì?
Trước khi đến với phần tính chất hóa học của ankan, chúng ta cùng tìm hiểu ankan là gì cũng như tên gọi của nó nhé.
Ankan là gì?
Ankan là hydrocarbon mạch hở. Phân tử ankan chỉ chứa các liên kết C – C và C – H. Điều này có nghĩa ankan là các hydrocarbon không tạo mạch vòng, trong đó mỗi phân tử chứa số nguyên tử hydro cực đại và không chứa các liên kết đôi.
Công thức tổng quát của ankan là CnH2n+2 với n là số nguyên dương. Ankan đơn giản nhất là metan có công thức hóa học là CH4. Tiếp theo là êtan có công thức C2H6.
Tên gọi của ankan (danh pháp)
Tên gọi của ankan dựa vào vị trí mạch cacbon. Cụ thể như sau:
Mạch cacbon thẳng
Tên gọi ankan = tên mạch cacbon + an
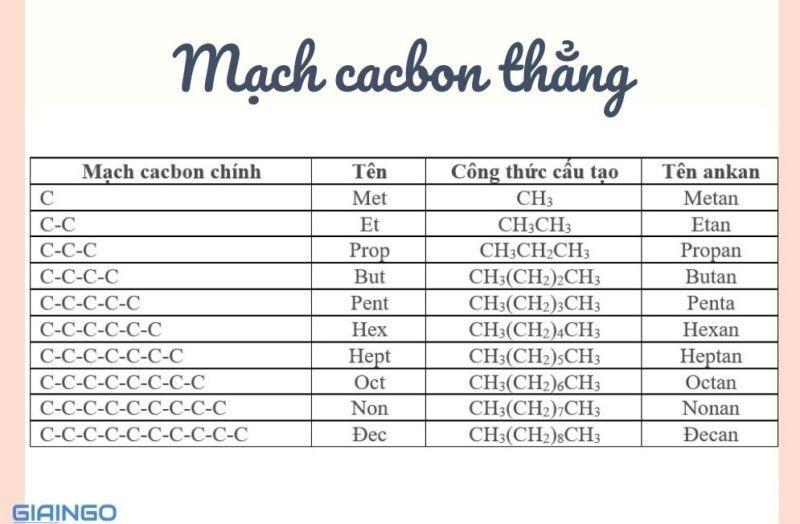
Mẹo nhỏ để ghi nhớ: Mẹ (Metan) Em (Etan) Phải (Propan) Bón (Butan) Phân (Pentan) Hóa (Hexan) Học (Heptan) Ở (Octan) Ngoài (Nonan) Đồng (Đecan).
Mạch cacbon có nhánh
- Chọn mạch chính : là mạch dài nhất có nhiều nhóm thế nhất.
- Đánh số vị trí cacbon trong mạch chính bắt đầu từ phía gần nhánh hơn.
- Gọi tên: Vị trí mạch nhánh + tên nhánh + tên mạch chính (tên ankan tương ứng với số nguyên tử cacbon trong mạch chính).

Tính chất hóa học của ankan
Có 3 tính chất hóa học của ankan mà bạn cần phải nắm vững. Đừng vội bỏ qua nếu bạn chưa tìm hiểu cùng Chúng Tôi nhé.
Phản ứng thế (Cl2, Br2)
- Khi chiếu sáng hoặc đốt nóng hỗn hợp metan và clo xảy ra phản ứng thế lần lượt các nguyên tử hiđro bằng clo.
Các phương trình hóa học xảy ra:
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH3Cl3 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
- Các đồng đẳng của metan cũng tham gia phản ứng thế tương tự như metan.
- Phản ứng thế H bằng halogen thuộc loại phản ứng halogen hóa, sản phẩm hữu cơ có chứa halogen gọi là dẫn xuất halogen.
- Khả năng phản ứng của dãy halogen F2 > Cl2 > Br2 > I2.
- Phản ứng Br hóa có khả năng phản ứng chậm hơn Cl hóa nhưng có độ chọn lọc cao.
Phản ứng tách của ankan
Phản ứng tách của ankan được chia thành 3 loại. Chúng ta cùng xem đó là những loại nào nhé.
Phản ứng tách H2 của ankan
Phản ứng này còn gọi là phản ứng đề hidro hóa. Công thức tổng quát: CnH2n+2 → CnH2n + H2
Chỉ những ankan trong phân tử có từ 2 nguyên tử C trở lên mới có khả năng tham gia phản ứng tách H2. Trong phản ứng tách H2, 2 nguyên tử H gắn với 2 nguyên tử C nằm cạnh nhau tách ra cùng nhau và ưu tiên tách H ở C bậc cao.
Phương trình hóa học: CH3-CH2-CH3 → CH2=CH-CH3 + H2
Lưu ý một số trường hợp sau:
CH3-CH2-CH2-CH3 → 2H2 + CH2=CH-CH=CH2
CH3-CH(CH3)-CH2-CH3 → CH2=C(CH3)-CH=CH2 + 2H2
n-C6H14 → 4H2 + C6H6 (benzen)
n-C7H16 → 4H2 + C6H5CH3 (toluen)
Phản ứng tách mạch cacbon của ankan (n≥ 3)
Phản ứng tách mạch cacbon của ankan còn gọi là phản ứng cracking xảy ra ở điều kiện nhiệt độ, áp suất và xúc tác thích hợp. Công thức tổng quát: CnH2n+2 → CxH2x+2 + CyH2y
Lưu ý: ankan thẳng CnH2n+2 khi cracking có thể xảy ra theo (n – 2) hướng khác nhau tạo ra 2(n-2) sản phẩm. Số mol ankan sau phản ứng luôn bằng số mol ankan ban đầu dù quá trình cracking có nhiều giai đoạn.
Phản ứng phân hủy của Ankan
Ankan bị phân hủy bởi nhiệt. Công thức tổng quát: CnH2n+2 → nC + (n+1)H2
Phản ứng phân hủy bởi halogen có công thức tổng quát: CnH2n+2 + nCl2 → CnCl2n+2 + (n+1)H2
Phản ứng oxy hóa ankan
Ankan bền với tác nhân oxy hóa ở nhiệt độ thường. Ở nhiệt độ cao hoặc có mặt xúc tác có thể phản ứng với oxi, KMnO4, K2Cr2O7 để tạo thành ancol, andehit, xeton, acid carboxylic…
Công thức tổng quát: 2CnH2n+2 + (3n + 1)O2 → (nhiệt độ) 2nCO2 + (2n+2)H2O

Bài viết liên quan:
- Tính chất hoá học của muối là gì? Bài tập Hoá lớp 9
- Tổng hợp 5 tính chất hóa học của bazơ bạn nên biết
- Tính chất hóa học của axit? 5 ứng dụng axit phổ biến nhất
Tính chất vật lý của ankan
Ở điều kiện thường, ankan từ C1 đến C4 ở trạng thái khí, từ C5 đến C17 ở trạng thái lỏng, từ C18 trở lên ở dạng rắn.
Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của ankan nói chung tăng theo số nguyên tử C trong phân tử tức là theo chiều tăng của phân tử khối.
Ankan là những chất không màu, đều không tan trong nước, nhẹ hơn nước. Nó tan nhiều trong dung môi hữu cơ.
Cách điều chế và ứng dụng của ankan
Từ những tính chất hóa học của ankan, người ta điều chế và ứng dụng nó vào đời sống hằng ngày. Cùng tìm hiểu với Chúng Tôi xem đó là gì nhé.
Cách điều chế ankan
Có hai cách để điều chế ankan. Cụ thể đó là:
Trong công nghiệp
Điều chế ankan bằng cách tách từ nguồn khí thiên nhiên như metan, khí mỏ dầu và dầu mỏ.
Phương trình điều chế:
C + 2H2 → (Ni, nhiệt độ 500 độ C) CH4
CO + 3H2 → (xúc tác, nhiệt độ) CH4+ H2O
Trong phòng thí nghiệm
Ankan được điều chế bằng cách nung muối natri của axit cacboxylic với vôi tôi xút.
Phương trình điều chế:
CH3COONa + NAOH (rắn) → (CaO, nhiệt độ) CH4 + Na2CO3
Ứng dụng của ankan
Dựa trên tính chất hóa học của ankan, nó được ứng dụng rất nhiều trong đời sống. Cụ thể:
- Ankan dùng làm nguyên liệu trong đèn xì để hàn, cắt kim loại.
- Làm dầu bôi mỡ bôi trơn, chống gỉ.
- Sáp pha thuốc mỡ và đun nấu
- Làm dung môi.
- Ứng dụng để tổng hợp nhiều chất hữu cơ khác như CH3Cl, CH2Cl2 , CCl4, CF2Cl2…

Một số bài tập về ankan tham khảo
Để củng cố nội dung về tính chất hóa học của ankan, Chúng Tôi sẽ gửi đến bạn một số bài tập tham khảo.
Bài 1: Ankan Y phản ứng với clo tạo ra 2 dẫn xuất monoclo có tỉ khối so với hidro là 39,25. Tên của Y là:
A. Butan
B. Propan
C. Iso-butan
Hướng dẫn giải
Đặt công thức của Y là CnH2n+2
Phương trình hóa học
CnH2n+2 + Cl2 → (nhiệt độ, ánh sáng) CnH2n+1Cl + HCl
Theo đề CnH2n+1Cl gồm 2 đồng phân và khối lượng mol của là CnH2n+1Cl = 39,25 x 2 = 78,5 (gam/mol)
Ta có 14n + 36,5=78,51 → n = 3
CTPT của Y là C3H8 nên Y là propan
2 sản phẩm tạo thành là CH3CH2CH2Cl và CH3CHClCH3
Chọn đáp án B.
Bài 2: Cracking 8,8 gam propan thu được hỗn hợp khí A gồm H2, CH4, C2H2, C3H6 và một phần propan chưa bị cracking. Biết H% = 90%. Khối lượng phân tử trung bình của A là
A. 39,6
B. 23,16
C. 2,135
Hướng dẫn giải
Theo định luật bảo toàn khối lượng: m A = m Propan = 8,8 gam
n C3H4 ban đầu = 8,8 / 44 = 0,2 mol
→ nC3H4 pư = 0,2 x 90% = 0,18 (mol)
n C3H4 dư = 0,02 mol
Vậy sau pư số mol khí tạo thành = 0,18 x 2 + 0,02 = 0,38 mol
→ MA = 8,80,38 = 23,16
Chọn đáp án B
Bài 3: Nung m gam hỗn hợp gồm 3 muối natri của 3 axit hữu cơ no, đơn chức với NaOH dư, thu được chất rắn D và hỗn hợp Y gồm 3 ankan. Tỉ khối của Y so với H2 là 11,5. Cho D tác dụng với H2SO4 dư thu được 17,92 lít CO2 (đktc). Tên của 1 trong 3 ankan và giá trị của m là
A. metan và 71,2
B. etan và 84,4
C. propan và 42,4
Hướng dẫn giải
Đặt công thức trung bình của 3 muối natri của 3 axit hữu cơ no, đơn chức là CnH2n+1COONa
Phương trình hóa học:
CnH2n+1COONa + NaOH → (nhiệt độ, CaO) CnH2n+2 + Na2CO3 (1)
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2 (2)
Theo phương trình (1) và (2) ta có
n Na2CO3 = nCnH2n+2 = nNaOH = nCO2 = 17,92 / 22,4 = 0,8 (mol)
Áp dụng định luật bảo toàn khối lượng: m X + m NaOH = m CnH2n+2 + m Na2CO3
→ m X = 0,8 x 106 + 11,5 x 2 x 0,8 − 0,8 x 40 = 71,2 (gam)
M Y = 14n + 2 = 23 → n = 1,5
Suy ra trong 3 ankan có 1 ankan là CH4
Chọn đáp án A
Bài 4: Đốt cháy hoàn toàn 1 thể tích khí thiên nhiên gồm metan, etan, propan bằng oxi không khí (trong không khí có chứa 20% O2), thu được 7,84 lít CO2 (đktc) và 9,9 gam H2O. Thể tích không khí (đktc) nhỏ nhất cần dùng để đốt chất khí thiên nhiên trên là
A. 70 lít
B. 78,4 lít
C. 84 lít
Hướng dẫn giải
Đăt công thức chung của 3 khí thiên nhiên là CmH2m+2
n CO2 = 7,84 / 22,4 = 0,35 (mol)
n H2O = 9,9 / 18 = 0,55 (mol)
Phương trình hóa học: CmH2m+2 + O2 → (nhiệt độ) CO2 + H2O
Tỉ lệ tương ứng: x 0,35 0,55
Áp dụng định luật bảo toàn nguyên tố ta có 2x = 0,35 x 2 + 0,55
→ x = 0,625 (mol)
→ VCO2 = 0,625 x 22,4 = 14 lít
→ V kk = 5 x 14 = 70 lít
Chọn đáp án A

Vừa rồi Chúng Tôi đã chia sẻ cho bạn kiến thức về tính chất hóa học của ankan. Hy vọng bài viết trên hữu ích cho quá trình nghiên cứu của bạn. Đừng quên theo dõi Chúng Tôi mỗi ngày để biết thêm nhiều điều hay!
Trong hóa học, hiểu và nắm vững các tính chất của các hợp chất rất quan trọng để có thể áp dụng chúng vào nghiên cứu và ứng dụng. Đối với ankan – một loại hợp chất hữu cơ cơ bản, có ba tính chất hóa học quan trọng mà người học cần phải phân biệt và nắm vững.
Thứ nhất, vào tính chất không bão hòa. Ankan đặc trưng bởi việc không có liên kết pi trong cấu trúc phân tử. Điều này dẫn đến tính chất bền và ít phản ứng của ankan. Điển hình là hidrocarbon bậc một, như metan, chỉ có một liên kết đơn giữa các nguyên tử cacbon. Do không có liên kết pi nên các phản ứng tạo mới hay phá vỡ liên kết của ankan thường chỉ xảy ra ở điều kiện cực kỳ cô lập và khó xảy ra tự nhiên.
Thứ hai, tính chất không phân cực. Đối với ankan, hợp chất có thành phần chỉ gồm cacbon và hidro, không có các nhóm chức có tính phân cực như nhóm chức hydroxyl (-OH) hoặc nhóm chức amine (-NH2). Do đó, ankan là các chất không phân cực, không hòa tan trong nước hoặc các dung môi có tính phân cực cao. Điều này cũng làm giảm tính khử của ankan, ảnh hưởng tới tính tác dụng với các chất khác có tính chất phân cực cao.
Thứ ba, khả năng trao đổi chất. Ankan là một hợp chất rất quan trọng trong quá trình chuyển hóa cơ bản của các sinh vật. Chúng tham gia vào quá trình trao đổi chất trong các tế bào và cung cấp năng lượng cho các quá trình sống cơ bản. Từ mạch mở đến mạch không phân cực, ankan có thể được chuyển hóa, cháy chứng tỏ khả năng trao đổi chất và tạo năng lượng trong cơ thể.
Tổng kết lại, ankan là một hợp chất không bão hòa, không phân cực và có khả năng trao đổi chất. Các tính chất này có ý nghĩa quan trọng trong các ứng dụng hóa học, sinh học và dược học. Hiểu rõ các tính chất này sẽ giúp chúng ta áp dụng và tận dụng tối đa tiềm năng của ankan trong các lĩnh vực khác nhau.
Cảm ơn bạn đã xem bài viết 3 tính chất hóa học của ankan mà bạn cần phải nắm vững tại thcshuynhphuoc-np.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Bền vững: Ankan là các hợp chất hữu cơ không phản ứng dễ dàng với các chất khác, chúng có thể tồn tại trong môi trường tự nhiên trong một thời gian dài.
2. Không hoá học: Ankan không phản ứng với nước, axit hay base, làm cho chúng trở thành các hợp chất không hoá học.
3. Cấu trúc đơn giản: Ankan chỉ gồm các nguyên tử cacbon và hydro, cho nên chúng có cấu trúc đơn giản và ít phức tạp.
4. Độc lực: Một số ankan có thể gây ra tổn thương cho các tế bào và cơ quan của con người nếu tiếp xúc lâu dài hoặc hít phải nhiều.
5. Khả năng cháy: Các ankan như metan và etan có khả năng cháy, là nguyên liệu quan trọng trong ngành công nghiệp và nấu ăn.
6. Khó tan: Ankan không tan trong nước nhưng có thể tan trong các dung môi hữu cơ như cồn, benzen và dầu.
7. Điểm sôi: Điểm sôi của các ankan tăng theo sự gia tăng các liên kết cacbon-hidro và kích thước phân tử.
8. Khả năng làm giảm oxy trong môi trường: Ankan có khả năng làm giảm lượng oxy có sẵn trong môi trường khi cháy, gây nguy hiểm đối với người và động vật.
9. Tính không phạm vi: Ankan có thể tồn tại ở các dạng khí, chất lỏng và chất rắn, tùy thuộc vào số lượng nguyên tử cacbon và hidro trong phân tử.
10. Tính không màu: Các ankan không có màu sắc đáng kể, điều này khiến cho chúng trở thành các chất rất khó phát hiện bằng phương pháp thị giác.
11. Tính hợp chất tham gia nhiều phản ứng hóa học: Ankan tham gia vào nhiều phản ứng hóa học quan trọng như oxi hóa, cộng hoá học và thế hoá học.
12. Khả năng tạo ra sản phẩm phụ: Trong quá trình oxi hóa và cháy, ankan có thể tạo ra các sản phẩm phụ độc hại như carbon monoxide và carbon dioxide.
13. Khả năng tạo ra hợp chất mới: Ankan có thể tham gia các phản ứng hóa học để tạo ra các hợp chất mới cùng với các nguyên tử khác nhưí oxi, nitơ và lưu huỳnh.
14. Tính độc hại với môi trường: Một số ankan như ethylene đã được liệt kê là chất gây ô nhiễm môi trường và gây thiên tai.
15. Tính phân cực: Ankan có tính phân cực thấp, điều này dẫn đến tính chất không hòa tan trong nước và tạo thành lớp màng bảo vệ phần không phân cực.


